Diseño Digital 3D a Medida para Defectos Óseos de Cadera
REVISTA ACARO | VOL. 6, N° 1: 1-7 | 2020
ARTÍCULO ORIGINAL
Diseño Digital 3D a Medida para Defectos Óseos de Cadera
Mauro Damián Belzino, Juan Ottolenghi, Mariano Lupacchini, Flavio Ivalde, Roberto Espagnol, Luis Marcelo Melo
Equipo de Cadera y Rodilla, Departamento de Ortopedia y Traumatología, Hospital de Clínicas “José de San Martín”, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina
Mauro D. Belzino
mbelzino@gmail.com
Recibido: Mayo de 2020. Aceptado: Junio de 2020.
RESUMEN
Los defectos acetabulares plantean un desafío para la reconstrucción articular mediante una artroplastia de cadera debido al problema en la fijación del implante y en la duración a largo plazo de la reconstrucción. Utilizando los beneficios que trae el uso del metal trabecular (MT) y debido a los buenos resultados reportados que se presentan a corto y mediano plazo las reconstrucciones con suplementos de dicho material, se plantea mejorar la resolución de estos defectos valiéndonos de las características del MT mediante la manufactura de implantes a medida con técnica aditiva de impresión en tres dimensiones (3D) ajustados en forma personalizada a cada defecto en particular. Por eso, nuestro objetivo es presentar un protocolo de elaboración de estos implantes que involucra cada paso desde el diagnóstico hasta su construcción final. Este proceso nos simplificaría los procedimientos quirúrgicos, resolviendo los defectos presentes en forma individual, con una mejor estabilidad y mayores chances de osteointegración a largo plazo.
Palabras clave: Defectos Acetabulares; Impresión 3D; Metal Trabecular; Implante A Medida Acetabular
ABSTRACT
Acetabular defects pose a challenge for joint reconstruction with a hip arthroplasty due to the problem in the fixation of the implant and the long-term osseointegration of the reconstruction. Using the benefits of trabecular metal (MT) and owing to the good results reported in the short- and medium-term reconstructions with supplements made out of this material,
We propse to enhance the resolution of these defects by useing the characteristics of MT for the manufacture of customized implants througth three dimensions (3D) printing with additive technique, adjusted in a personalized way to each defect in particular.
That is why our goal is to present a protocol for the makeing of these implants that involves every step from diagnosis to its final construction. This process would simplify surgical procedures, solveing each defect individually, with better stability and greater chances of long term osseointegration.
Key words: Acetabular Defects; 3D Printing; Trabecular Metal; Patient Specific Acetabular Implant
INTRODUCCIÓN
Los defectos óseos durante la revisión acetabular de la artroplastia total de cadera plantean un problema en la fijación del implante y en la duración a largo plazo de dicha reconstrucción. Actualmente, se han desarrollado muchas técnicas quirúrgicas para la cirugía de revisión protésica para los defectos del complejo acetabular, pero no se ha alcanzado un consenso sobre el mejor tratamiento.
Los defectos óseos acetabulares tipificados según la clasificación de Paprosky como IIC, IIIA y IIIB, presentaron una falla de más del 30% a los 10 años de seguimiento al tratarlos con injertos estructurales y anillos de refuerzo, debido a esto surge la necesidad del uso de metal trabecular (MT) en sus diferentes formas de presentación tanto de tantalio como de titanio, mediante cuñas y suplementos con buenos resultados a mediano plazo. Entre sus propiedades podemos nombrar la biocompatibilidad, su resistencia a la corrosión, alta porosidad, alto coeficiente de fricción, fijación inicial y osteoconducción.1-3
Utilizando las bondades y los beneficios del MT combinados con las nuevas tecnologías de reconstrucción 3D, comenzamos a utilizar implantes a medida para solucionar estos difíciles defectos óseos acetabulares.
El objetivo de este trabajo es presentar un protocolo de planificación pre quirúrgico y reconstrucción de defectos acetabulares severos, utilizando implantes customizados a medida del paciente de metal trabecular fabricados mediante técnica aditiva de impresión en tres dimensiones (3D).
MATERIAL Y MÉTODOS
Desde el año 2014, seguimos un protocolo de estudio y tratamiento en 18 pacientes que presentaron defectos acetabulares severos. Pare ello, utilizamos como criterios de inclusión la presencia de un defecto acetabular según la clasificación de Paprosky IIc, IIIa o IIIb, y se utilizaron como criterios de exclusión la presencia de defectos acetabulares solucionables con implantes estándar sin agregado de injerto, las infecciones activas y a aquellos pacientes que rechazaron el tratamiento mediante este protocolo. En este proyecto no se realizó análisis estadístico.
No existiendo reglamentación o protocolo al respecto, se siguen las normas de estudio clínico en tecnología médica y las normas éticas de la Declaración de Helsinki en su última versión (Fortaleza 2013) y la Ley Nacional de Protección de Datos Personales n° 25.326.
1. PRIMERA ETAPA. DIAGNÓSTICO.
Etapa de Diagnóstico e Indicación
El cirujano que recibe al paciente y analiza los estudios por imágenes evalúa la posibilidad de reconstrucción de acuerdo al defecto presente. Se indica principalmente en lesiones de cótilo combinadas, según la clasificación de Paprosky IIC, IIIA y IIIB, con evidente aflojamiento del cótilo que implique no perder stock óseo al momento de la extracción, en caso de infección con defecto acetabular, será tratada con espaciador de cemento con antibiótico que se cambiará periódicamente hasta que los cultivos sean negativos.
Se realiza una tomografía computada (TC) que debe tener las siguientes características (tabla I), para poder desarrollar un diseño que se ajuste a la medida exacta de la patología o en su defecto debe hacerse con un Fantoma de testigo.
2. SEGUNDA ETAPA. PLANIFICACION Y DISEÑO
Etapa de diseño del implante asistido por computación
Estará a cargo de un diseñador experto en diseño 3D asistido por computación (CAD) y en tecnología de impresión 3D.
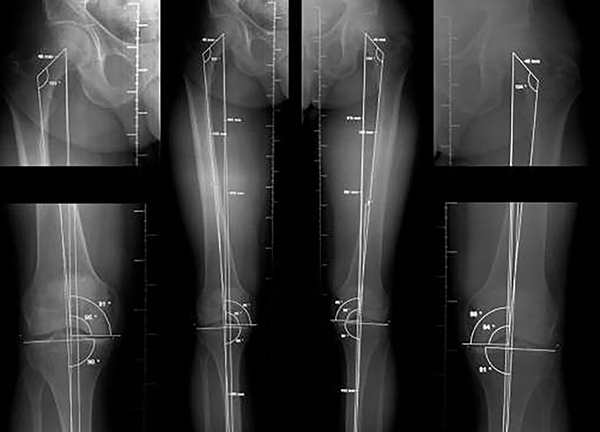
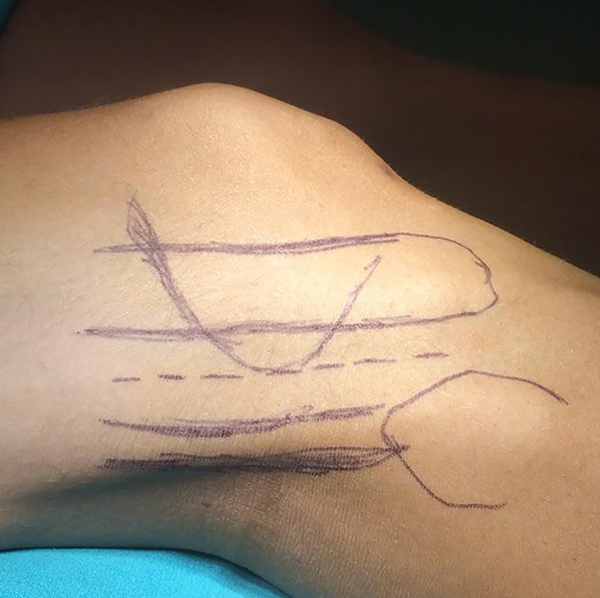
El primer paso es comprobar que la TC esté hecha según técnica solicitada, y que los puntos de reparo permiten asegurar que las medidas del diseño coincidirán con la anatomía del paciente. Ante la duda deberá repetirse porque un error de dimensión puede acarrear inconvenientes intra y post-quirúrgicos (fig. 1).
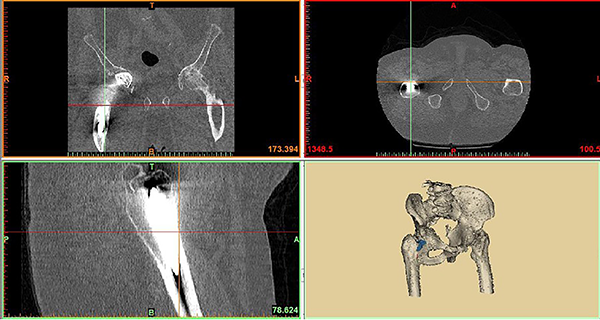
Figura 1: Medición tomográfica.
El segundo paso es el desarrollo del CAD (fig. 2) que nos permite visualizar sin superposición el defecto a tratar, la presencia de daño en paredes y fondo del acetábulo; el tamaño del mismo, del cual se ha establecido que cuando es menor de 50 mm deberá cotejarse con un modelo anatómico sintético de la pelvis para evaluar si puede ser tratado con un cótilo convencional.
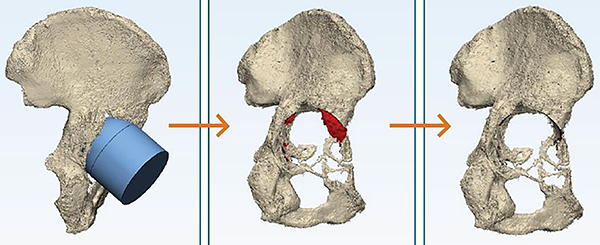
Figura 2: Desarrollo de modelo tridimensional.
Puede medirse además la densidad ósea de la pelvis para evaluar el impacto que puede generar el apoyo del implante y programar los orificios del diseño, donde los tornillos de fijación tendrán mejor anclaje medido por las unidades Hounsfield (UH). Se puede también diagramar el tamaño y lugar del poro que tendrá el mismo y hacer estudio mecánico mediante programa de cálculo finito (figs. 3 y 4).
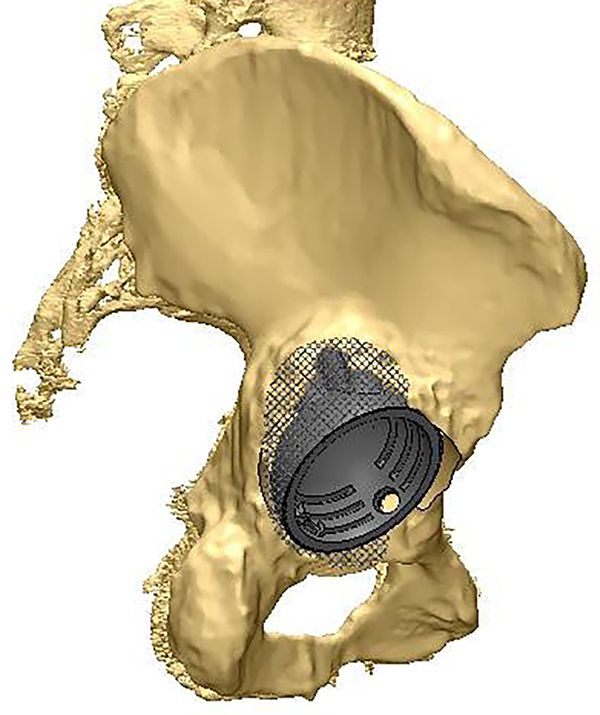
Figura 3: Planificación del implante.
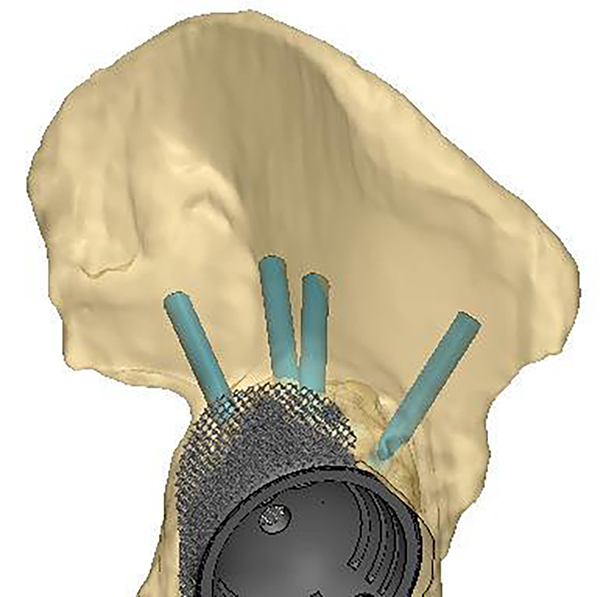
Figura 4: Orientación de los tornillos.
En tercer término, esto se cotejará con el cirujano para definir la impresión 3D de la hemipelvis con el defecto y del implante en material sintético para tener una imagen de la patología realmente anatómica, que permite ratificar o corregir los detalles de la técnica quirúrgica. Estos modelos sintéticos están hechos de un material esterilizable para poder tenerlos en la mesa de cirugía y cotejarlos con la lesión del paciente (figs. 5 y 6).

Figura 5: Hemipelvis sintética.

Figura 6: Hemipelvis sintética.
3. TERCER ETAPA. DISEÑO DEL PROTOTIPO PLÁSTICO
Etapa de impresión del modelo definitivo:
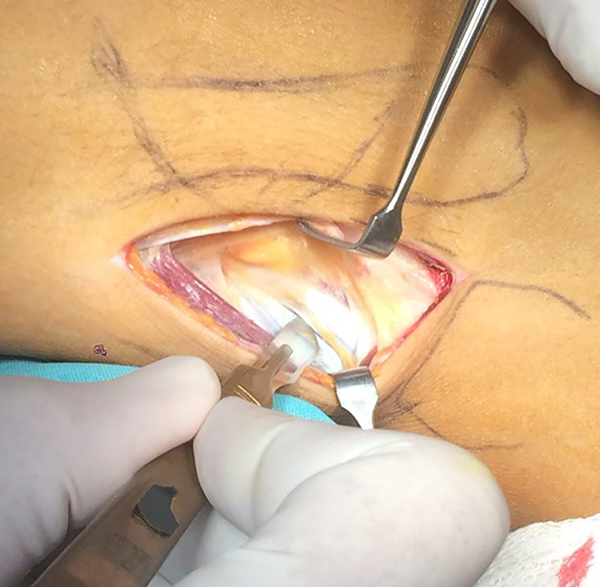
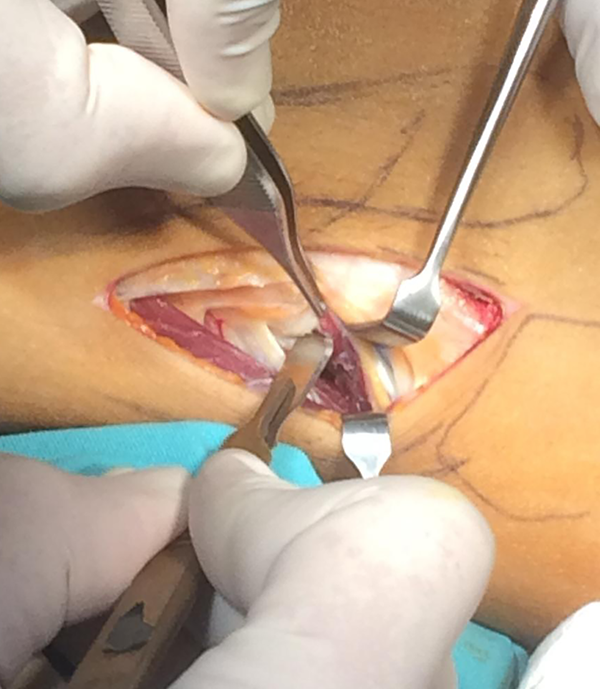
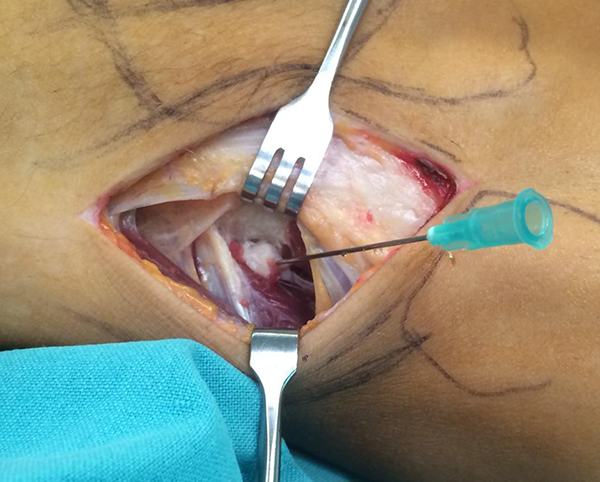
Con la conformidad del equipo quirúrgico se procede a la fabricación del modelo plástico donde se define la superficie a contactar con el hueso de la pelvis, su porosidad, formado además por una concavidad sólida de al menos 2 mm de espesor cuyo diámetro interno no debería ser menor de 50 mm para aceptar el cementado de un cótilo protésico, su localización y orificios serán estipulados por el cirujano con los modelos sintéticos (figs. 7 y 8).
Luego de la evaluación del modelo plástico definitivo, se propondrán mejoras hasta lograr la conformidad y aceptación del diseño del biomodelo por el cirujano.

Figura 7: Modelo definitivo.
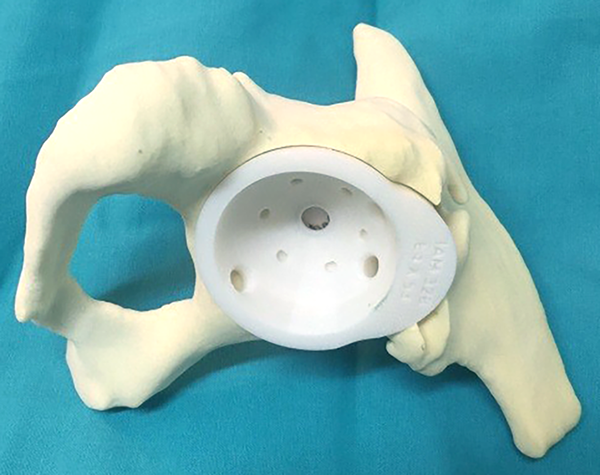
Figura 8: Modelo definitivo.
4. CUARTA ETAPA. ELABORACIÓN DEFINITIVA
Etapa de elaboración del implante definitivo:
Se trata de la elaboración en titanio poroso del implante definitivo a medida con técnica de impresión 3D, de forma aditiva según lo evaluado con los modelos plásticos y dado en conformidad por el cirujano. Una casa de ortopedia es la responsable de la fabricación del implante con el aval del diseño definitivo y luego de realizado el mismo requiere aprobación de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para su utilización. Para su elaboración se utiliza una aleación de Titanio 6 Aluminio 4 y Vanadio (Ti6Al4V ELI) por manufactura aditiva ASTM F 3001-14, con una fuerza de rendimiento de 950 megapascales (Mpa) y resistencia a la tracción de 970 Mpa. En cuanto a su porosidad, cada celda de la estructura trabecular está construida en base a un dodecaedro. La forma en que se mide el tamaño de la celda es a través del diámetro de la esfera inscrita dentro del dodecaedro. El diámetro de la misma es de 600 µm (micrones) que es lo óptimo según las publicaciones sobre estructuras para facilitar su osteointegración.
Lo que se busca con el implante definitivo es tener una superficie porosa en contacto con el hueso, la sustitución máxima de todos los defectos, la presencia de orificios para tornillos de anclaje con una orientación especifica que asegure la dirección óptima en el hueso medido según UH para lograr tener máximo contacto y anclaje en ilion, isquion y pubis, una concavidad amplia donde colocar el implante acetabular elegido, ya sea convencional, de movilidad dual o constreñido con ángulos óptimos de orientación según la planificación.
RESULTADOS
Con un total de 18 pacientes desde 2014, siguiendo este protocolo, observamos que el mismo ayuda a la interpretación del defecto acetabular, mejora la planificación preoperatoria, acorta el tiempo quirúrgico y simplifica la cirugía.
DISCUSIÓN
Los defectos acetabulares comprometen seriamente tanto la mecánica como la fijación del componente acetabular. Los tipos I, IIA y IIB de la clasificación de Paprosky pueden ser tratados con cotilos porosos con y sin utilización de injertos, demostrando ser una solución efectiva a mediano y largo plazo.4-6 En los defectos acetabulares mayores, de tipo IIC y III A y IIIB de la clasificación de Paprosky, en donde hay migración del centro de rotación mayor de 3 cm y no existe soporte del domo superior, los cótilo porosos tienen menos del 50 % de contacto con hueso huésped que si no se los asocia con injerto estructural van a presentar una alta tasa de fracasos.7
Los defectos cavitarios aislados son de relativa poca importancia ya que se pueden rellenar con injerto molido y colocar una copa acetabular no cementada sin generar fallas en la fijación del nuevo implante. Pero en aquellos defectos del techo o de la columna posterior, con gran migración del acetábulo protésico, es muy importante ubicar a la cadera en su posición anatómica, por lo que el nuevo implante necesitará de una estructura adicional que tendrá que ser generada por el cirujano para poder dar fijación primaria a la copa acetabular. Los defectos tienen mayor relevancia cuando son segmentarios más que cavitarios, y más aún si estos se ubican en la zona de transmisión de carga de la articulación, como los del techo acetabular. En los últimos años la tendencia es a utilizar el MT para solucionar este tipo de defectos.
Tanto el titanio y como el tantalio, tienen propiedades químicas similares, se encuentran muy cercanos en la tabla periódica por lo cual, los implantes fabricados a base de estos minerales poseen características de elasticidad muy similares al hueso. Tantalio (Ta) y Titanio (Ti) son metales de transición conocidos por excepcional resistencia a la corrosión y biocompatibilidad.
Los implantes de MT se caracterizan por generar un aumento en la densidad ósea periférica, un mayor crecimiento volumétrico que en cótilo porosos, y el relleno espontáneo de las pequeñas brechas además de presentar como ventaja la ausencia de uso de injerto estructural dando soporte y estabilidad mecánica de por sí, permitiendo una fácil reconstrucción y evitando la posible transmisión enfermedades con injertos de banco.
Recientes reportes utilizando cótilo y aumentos de MT para revisiones acetabulares han mostrado a corto plazo resultados prometedores.1,8-10 Los mismos presentan una mayor superficie porosa y un alto coeficiente de fricción, lo que le da una estabilidad inicial a la reconstrucción apta para el crecimiento óseo.1-3,11
Coincidimos con la bibliografía internacional en que la planificación preoperatoria es crucial para la reconstrucción de todos estos tipos de defectos severos, por lo cual realizamos rutinariamente el plantillado preoperatorio marcando el centro de rotación de la cadera. Comenzamos por el lado sano midiendo el componente acetabular correcto y lo traspolamos al lado contralateral, de esa forma podemos identificar nuestro defecto acetabular.12
Algunos autores como Yang Y, utilizan sistemáticamente la TC con reconstrucción 3D para evaluar el defecto acetabular en casos complejos de displasia del desarrollo de la cadera, recomendando dicho estudio para la mejor interpretación del defecto en el preoperatorio.13
Para Klavalerskly et al., el uso de modelos de yeso en 3D para la revisión de la artroplastia de cadera en la planificación con defectos acetabulares complejos, ha demostrado una gran precisión en la comprensión clara de la deficiencia de hueso acetabular con una diferencia entre lo planificado y lo realizado de menos de 2 mm.14
El diseño y la fabricación de los implantes a medida asistidos por computadora, se están utilizando actualmente como un enfoque alternativo e innovador para la restauración de articulaciones en casos de rescate, también se incorporan concentrado de células madre esqueléticas autólogas para optimizar la capacidad regenerativa puede mejorar la osteointegración del implante.15 Gorianov et. al. presenta una serie de casos de 11 pacientes con discapacidad severa y pérdida ósea significativa debido a reemplazos articulares fallidos. La elección de los implantes a medida con impresora de MT y células madre esqueléticas autólogas dio lugar a mejorías clínicas y radiológicas en el seguimiento de los pacientes.15
Citak y Gehrke nos muestran su experiencia preliminar en 9 pacientes con la técnica del componente acetabular específico del paciente, y refieren que es prometedora para el tratamiento con defectos acetabulares graves en revisión de reemplazo total de cadera e indican que se justifica realizar investigaciones adicionales dirigidas a reducir costos y mejorar la tasa de complicaciones,16 aseveraciones con las que coincidimos completamente ya que estos implantes aparentan ser la solución para estos defectos de tan difícil solución.
Berasi et al. formularon indicaciones para el uso de componentes de triflange personalizados en las revisiones de cadera. Las más importantes son reconstrucciones previas fallidas con aumentos de MT y “Cage” con la posibilidad de discontinuidad pelviana y defectos óseos masivos.17 Estamos de acuerdo con estas indicaciones y las utilizamos en nuestra práctica.
CONCLUSIÓN
La utilización del modelo en 3D, permite una visión extracorpórea del defecto acetabular que nos es útil para la planificación preoperatoria, docencia quirúrgica, orientación dentro del procedimiento operatorio, y así la reconstrucción del defecto acetabular de manera precisa y personalizada. Sin embargo, reconocemos que se requiere seguimiento a largo plazo para fortalecer estas conclusiones. En nuestro conocimiento no hay estudios comparativos a largo plazo, que permitan aseverar su buena evolución.
Con los implantes a medida se reportan reconstrucciones anatómicas que conllevan una menor demanda técnica en el intraoperatorio, lo que facilita el procedimiento y disminuye el tiempo quirúrgico, lo que nos haría pensar que a su vez traerían una merma en las complicaciones de tan ardua cirugía.
Creemos que se justifica realizar investigaciones adicionales dirigidas a reducir costos y ajustar las indicaciones para que la mayor parte de pacientes se vean beneficiados por esta tecnología.
BIBLIOGRAFÍA
- Sporer SM, Paprosky WG. Acetabular revision using a trabecular metal acetabular component for severe acetabular boneloss associated with a pelvic discontinuity. J Arthroplasty 2006;21(Suppl 2):87.
- Bobyn JD, Stackpool GJ, Hacking SA, et al. Characteristics of boneingrowth and interface mechanics of a new poroustantalum biomaterial. J Bone Joint Surg Br 1999;81:907.
- Bobyn JD, Pillar RM, Cameron HU, et al. The optimum pore size for the fixation of porous surfaced metal implants by the in growth on bone. Clin Orthop Relat Res 1980; 150:263.
- Weeden SH, Paprosky WG. Porous-ingrowth revision acetabular implants secured with peripheral screws. A minimum twelve year follow-up. J Bone Joint Surg Am 2006; 88:1266.
- Hungerford DS, Jones LC. The rationale of cementless revision of cemented arthroplasty failures.ClinOrthop1988; 235:12.
- Engh CA, Griffin WL, Marx CL. Cementless acetabular components. J Bone Joint Surg1990;72:53.
- Sporer SM, O’Rourke M, Chong P, et al. The use of structural distal femoral allografts for acetabular reconstruction. Average ten-year follow-up. J BoneJointSurg Am 2005;87:760.
- Paprosky W, Perona P, Lawrence J. Acetabular defect classification and surgical reconstruction in revision arthroplasty: a 6-year follow-up evaluation. J Arthroplasty1994; 9:33.
- Unger AS, Lewis RJ, Gruen T. Evaluation of a porous tantalum uncemented acetabular cup in revision total hip arthroplasty: clinical and radiological results of 60 hips. J Arthroplasty2005; 20:1002.
- Davies J, Laflamme G, Delisle J, et al. Trabecular metal used for major boneloss in acetabular hip revisión. J Arthroplasty. 2011; 8:26.
- Zhang YAP, Fitzpatrick DC, Heiner AD, et al. Inter facial frictional behavior: cancellous bone, cortical bone, and a novel porous tantalum biomaterial. J Musculoskelet Res 1999;3:245.
- Paniego G, Buttaro M, González Della Valle A, Piccaluga F: Utilidad y predictibilidad de un método de planeamiento preoperatorio para artroplastía total de cadera. Revista de la Asociación Argentina de Ortopedia y Traumatología. 2003.
- Yang Y, Morphological Analysis of True Acetabulum in Hip Dysplasia (Crowe Classes I-IV) Via 3-D Implantation Simulation. J Bone Joint Surg Am. 2017 Sep 6;99(17):e92.
- Kavalerskiy GM, Three Dimensional Models in Planning of Revision Hip Arthroplasty with Complex Acetabular Defects. Indian J Orthop. 2018 Nov-Dec;52(6):625-630. doi: 10.4103/ortho.IJOrtho_556_16.
- Goriainov V et al. Application of 3D-printed patient-specific skeletal implants augmented with autologous skeletal stem cells. Regen Med. 2018 Apr;13(3):283-294. Epub 2018 May 1.
- Citak M, Kochsiek L, Gehrke T. Preliminary results of a 3D-printed acetabular component in the management of extensive defects. Hip Int. 2018 May;28(3):266-271. Epub 2017 Apr12
- Berasi CC, Berend KR, Adams JB, Ruh EL, Lombardi AV., Jr Are custom triflange acetabular components effective for reconstruction of catastrophic bone loss? Clin Orthop Relat Res. 2015;473:528–35.
- Gross AE, Goodman SB. Rebuilding the skeleton: the intra operative use of trabecular metal in revision total hip arthroplasty. J Arthroplasty 2005;(Suppl 2):91.
- Levine B, Dela Valle CJ, Jacobs JJ. Applications of porous tantalum in total hip arthroplasty. J Am Acad Orthop Surg2006;14:646.
- Paprosky WG, Weeden SH, Bowling JW. Component removal in revision total hip arthroplasty. Clin Orthop2001;393:181.
- Harris WH. Traumaticarthritis of the hip afterdislocation and acetabular fractures: treatmentbymoldarthroplasty. J Bone Joint Surg Am 1969;51:737.
- Merle d’Aubigné RM, Post el M. Functional results of hip arthroplasty with acrylic prostheses. J Bone Joint Surg Am 1954;36:451.
- De Lee JG, Charnley J. Radiological demarcation of cemented sockets in total hip replacement. ClinOrthop1976; 121:20.
- Padgett DE, Kull L, Rosenberg A, et al. Revision of the acetabular component without cement after total hip arthroplasty. J Bone Joint Surg Am 1993;75:663.
- Berry D, Lewallen D, Hanssen AD, et al. Pelvicdiscontinuity in revision total hip arthroplasty. J Bone Joint Surg Am 1999;81:1692.
- Gross AE. Restoration of acetabular boneloss 2005. J Arthroplasty 2006;21(Suppl 1):117.
- Garbuz D, Morsi E, Gross A. Revision of the acetabular component of a total hip arthroplasty with a massive structural allograft. Study with a minimum five-year follow-up. J Bone Joint Surg Am 1996;78:693.
- Udomkiat P, Dorr LD, Won YY, et al. Technical factors for success with metal ring acetabular reconstruction. J Arthroplasty2001;16:961.
- Holt GE, Dennis DA. Use of custom triflanged acetabular components in revision total hip arthroplasty. Clin Orthop 2004; 429:209.
- Morsi E, Garbuz D, Gross AE. Revision total hip arthroplasty with shelf bulk allografts. A long-term follow-up study. J Arthroplasty1996;11:86.
- Woodgate IG, Saleh KJ, Jaroszynski G, et al. Minor column structural acetabular allografts in revision hip arthroplasty. Clin Orthop 2000:75.
- Chandler H, Lopez C, Murphy S, et al. Acetabular reconstruction using structural grafts in total hip replacement: a 12 1/2 yearfollow-up. SeminArthroplasty1995;6:118.
- Harris WH. Allografting in total hip arthroplasty: in adults with severe acetabular deficiency including a surgical technique for bolting the graft to the ilium. ClinOrthop; (162): 150-164; 1982.
- Yi LH, et al. Anatomical study based on 3D-CT image reconstruction of the hip rotation center and femoral offset in a Chinese population: preoperative implications in total hip arthroplasty. Surg Radiol Anat. 2019 Jan;41(1):117-124.
- Wells J et al. Femoral Morphology in the Dysplastic Hip: Three-dimensional Characterizations With CT. Clin Orthop Relat Res. 2017 Apr;475(4):1045-1054.