Osificación Heterópica de Cadera. Presentación y Etiopatogenia
REVISTA ACARO | VOL 4, Nº 1: 24-36 | 2018
ARTÍCULO ORIGINAL
Osificación Heterópica de Cadera. Presentación y Etiopatogenia
Guillermo Rodríguez Sammartino, Belisario Segura, Pablo Maletti
Hospital Provincial Neuquén. Neuquén, Argentina.
Pablo Maletti
pablomaletti@gmail.com
RESUMEN
La osificación heterotópica (OH) se define como la formación de hueso en los tejidos que normalmente no muestran propiedades de osificación. Se caracteriza por el rápido desarrollo de calcificación ósea en los tejidos blandos. El desarrollo de la OH se ha asocia con muchos factores predisponentes, incluyendo lesiones neurológicas, tanto en la médula espinal como en el cerebro, cirugía mayor articular y quemaduras. Existen marcadas variaciones en la incidencia y localización del hueso neoformado y en las complicaciones resultantes.
La incidencia de OH seguida a una lesión cerebral puede variar entre 11% y
22%. Las articulaciones más afectadas son la cadera, el codo y el hombro.
La OH sintomática, después de la artroplastia total de cadera (ATC) es relativamente rara. Los pacientes con alto riesgo de desarrollar OH después de la ATC incluyen hombres con osteoartritis hipertrófica bilateral, pacientes con una historia de OH en la otra cadera, y aquellos con artrosis postraumática (fractura de acetábulo) caracterizados por osteofitosis hipertrófica. Los pacientes con riesgo moderado son los que tienen Espondilitis Anquilosante, Hiperostosis Esquelética Idiopática Difusa o Enfermedad de Paget. Los regímenes de medicamentos profilácticos (Indometacina) y tratamientos de radiación de una sola dosis son efectivos para la prevención de OH después de la ATC.
La resección quirúrgica debe ser considerada en casos de anquilosis de la articulación o significativa disminución del rango de movimiento antes de que surjan complicaciones. La selección de los pacientes, el momento de la resección quirúrgica, y la profilaxis post-operatorias son importantes para la realización del tratamiento adecuado.
Palabras claves: Osificación Heterotópica; Cadera; Formación Heterotópica de Hueso; Lesión Medular; Trauma Cráneo-Encefálico
ABSTRACT
Heterotopic Ossification (OH) is the formation of lamellar bone within soft tissue structures where bone does not normally exist, usually between the muscle and the joint capsule.
The development of OH has been associated with many predisposing factors, including neurological injuries in both the spinal cord and brain, major joint surgery and burns. There are marked variations in the incidence and location of neoformed bone and in resulting complications.
The incidence of OH followed by brain injury can occur between 11% and
22%. The most affected joints are the hip, elbow and shoulder.
Symptomatic OH, after total hip arthroplasty (THA) is relatively rare. Patients with high risk include men with bilateral hypertrophic osteoarthritis, history of OH in the other hip, and those with posttraumatic osteoarthritis. Patients with moderate risk are those with ankylosing spondylitis, diffuse idiopathic skeletal hyperostosis, Paget’s disease.
Prophylactic drug regimens (indomethacin) and single-dose radiation treatments are effective for preventing OH after THA
Surgical resection should be considered in cases of ankylosis of the joint or significant decrease in range of motion. Patient selection, timing of surgical resection and post-operative prophylaxis are important for proper treatment.
Key words: Heterotopic Ossification; Hip; Heterotopic Bone Formation; Spinal Cord Injury; Traumatic Brain Injuries
INTRODUCCIÓN
La Osificación Heterotópica (OH) es la formación de hueso lamelar dentro de las estructuras de partes blandas donde el hueso normalmente no existe, usualmente entre el músculo y la cápsula articular. La OH fue descripta por primera vez en 1692 por Patin en niños con miositis osificante progresiva.1 En 1883, Riedel2 y, en 1918, Dejerine3 dieron una mejor descripción. Durante la 1° Guerra Mundial se vio mucha OH en soldados que quedaron parapléjicos por heridas de bala. En ese momento se relaciona el edema con lesiones traumáticas. Es en 1961 que baja la tasa de incidencia por mejor manejo del trauma.4
La OH puede ocurrir luego de traumatismos de partes blandas o fracturas, quemaduras severas, en asociación con tumores, luego de reemplazos articulares, especialmente Reemplazo Total de Cadera (RTC) o en vecindad a articulaciones espásticas o paralíticas secundarias a traumatismo craneoencefálico o trauma medular.5-10
Existe alguna asociación entre antígeno HLA B18, B27 y DW7 sobre todo en OH por lesiones nerviosas.11 El 75 % de los pacientes con lesión neurológica y OH tienen HLA B18 negativos.12
Las causas genéticas están siendo investigadas.12,13 Parece haber una asociación con la fibrodisplasia osificante progresiva (FOP).
Existen diferentes denominaciones a esta entidad: osificación ectópica, miositis osificante, fibromiopatía osificante neurogénica y paraosteoartropatía osificante.
La incidencia luego del RTC va desde 16% a 53%, y es mayor en pacientes con predisposición.14-17 Esta incidencia variable depende de los centros de estudio, población, período de estudio, método de adquisición de datos, y duración del seguimiento. La OH post RTC es más frecuente en varones.18 La OH Post-traumática puede ocurrir en cualquier lado, pero es más frecuente en la cadera luego de osteosintesis de fractura de acetábulo, la cual, ocurre entre el 18 al 90%. La limitación del rango de movilidad (ROM) inicial mejora con el paso del tiempo.19 Luego de lesión traumática o espinal, la cadera es el lugar más frecuente. La rodilla menos frecuente.
La incidencia en niños y ancianos es menor, sin embargo es habitual en niños con quemaduras severas.9,20
La OH se diagnostica a los 4 meses luego de una lesión cerebral traumática, hemorragia cerebral, hidrocéfalia, lesión de médula espinal y ahogamiento. No hay diferencia por sexo.1-3,5,10
FISIOPATOLOGÍA
La OH se origina en los tejidos conectivos contiguos al esqueleto, pero no involucra el periostio. Cuando se da cerca de una articulación, en general preserva la cápsula y el espacio articular.21 Las fibras musculares no están involucradas en forma primaria en el proceso, pero pueden ser incorporadas o comprimidas por la fibrosis y partes blandas calcificadas llevando a necrosis muscular local.22,23
La OH comienza en un área de reacción inflamatoria, con edema con aumento del flujo sanguíneo local en las partes blandas. Primero se ve una infiltración celular exudativa, seguida de proliferación fibroblástica la cual desarrolla una formación osteoide y el subsecuente depósito de matriz ósea. El material osteoide primitivo se deposita como masas pequeñas dentro de áreas de reacción mesenquimática fibroblástica alrededor de las dos semanas, comenzando por la periferia. Los osteoblastos producen tropocolágeno, que se polimeriza para formar colágeno, y comienzan a segregar fosfatasa alcalina (FA). La FA produce lisis del pirofosfato, quien es el encargado de evitar la formación de los depósitos cálcicos. Esta inactivación del pirofosfato, cerca de la matriz ósea ectópica en desarrollo, hace que la FA permita que el calcio precipite y la matriz se mineralice.15,21,22,24
Este proceso de mineralización de partes blandas consiste de una fase de fosfato cálcico amórfico que gradualmente es reemplazado por cristales de hidroxiapatita que se agrandan en forma progresiva. El patrón centrípeto, de afuera a adentro, es lo que se describe como “fenómeno de zona de ACKERMAN”.25
El fenómeno de zona es una fina región que rodea el músculo circundante envolviendo una zona intermedia más ancha. Esta zona intermedia tiene áreas de hueso inmaduro guiado por osteoblastos, mientras que en la zona región periférica hay hueso maduro en formación con un reborde trabecular bien demarcado. La zona intermedia rodea una zona central que tiene una proliferación altamente celular no diferenciada de fibroblastos con hemorragia y necrosis ósea. La zona central hipoecoica es la que tiene necrosis muscular, hemorragia y proliferación celular no-diferenciada. En la medida que esta lesión madura, el reborde periférico de la zona intermedia se vuelve radiográficamente opaco debido a la mineralización progresiva. Toda la secuencia completa de aduración ósea se completa usualmente dentro de de 6 a 18 meses.15,25,26
La OH madura se asemeja a hueso normal, tanto radiográficamente como por histología y consiste de hueso esponjoso con canales Harvesianos, cortical, vasos sanguíneos y médula osea, pero con menor capacidad hematopoyética.
De acuerdo con Chalmers27 tienen que existir tres condiciones para que se desarrolle OH, la presencia de células precursoras óseas, un agente inductivo y un ambiente permisivo.
Aunque el mecanismo causal preciso de la OH no se conoce, hay factores humorales, neurales y locales que probablemente jueguen un rol en la patofisiología.
Puede haber una migración de células mesenquimáticas distantes al área involucrada que luego se transforman en osteoblastos o la transformación de células mesenquimáticas locales directamente en osteoblastos.10,23,28
Factores humorales
Hay trabajos con estudio de plasma de pacientes con trauma cerebral o de médula espinal que indican que hay involucrados mecanismos humorales. Hay aumento de los factores de crecimiento osteoblástico y factores de estimulación osteoblástico en plasma de animales y pacientes con trauma medular-cerebral.29,30 También hay aumento de la actividad mitogénica que tiene un rol indirecto en el proceso de inducción ósea.
Existen estudios experimentales que demuestran una proteína osteo-inductiva que se libera del tejido óseo demineralizado que participa en el proceso de osteo-inducción. Este factor se denomina BMP (bone morphogenic protein) proteína morfogénica ósea.
Por lo tanto es posible que la reabsorción ósea y la degradación del colágeno, en pacientes con lesión medular aguda, libere factores osteo-inductivos (todavía no identificados).28
Factores neuro-inmunológicos
La influencia neural en el desarrollo de la osificación heterotópica neurogénica (OHN) tiene que ser tenida en cuenta debido a la alta incidencia en desórdenes neurológicos y por el confinamiento en las regiones del cuerpo con déficit neurológicos.
Una de las primeras teorías,1 sugería que el daño de las columnas simpáticas intermedio-laterales de la médula traumatizada predisponía la OHN a través de desregulación autonómica. A partir de una alteración del balance secundario dentro del sistema nervioso autonómico, ocurren una serie de cambios vasculares y metabólicos que favorecen la OH.1,3
Contrario a estas teorías es el hecho que en periodos iniciales de OH existen alteraciones microvasculares locales, como el aumento de la vascularidad, estasia venosa y fístulas Arterio-Venosa en los tejidos afectados. Estas modificaciones en la perfusión sanguínea y en los niveles de oxígeno de las partes blandas tienen un rol crítico en la formación de la OH lo que nos se sabe es si estos cambios son secundarios a o son el factor causal en la OH.
El hecho que haya edema intersticial, debido a desregulación autonómica, hipersensibilidad o hiponatremias, agrega un ambiente permisivo para la calcificación del osteoide.
Factores locales
Los factores locales que predisponen la OH son: estasia o trombosis venosa, infección local, ulceras por decúbito y micro-trauma. Todo esto lleva al daño de tejidos y consecuentemente a las reacciones inflamatorias que causan edema e hipoxia tisular,7 y predisponen de esta manera la formación de hueso ectópico ya sea proveyendo un ambiente permisivo o por la liberación de factores humorlaes a través de un proceso inflamatorio. Tanto la PG E2 como la Interleukina 1 pueden inducir la formación de hueso lamelar subperiotico y las inyecciones subcutáneas de PG E2 en ratas en crecimiento provocan la formación de hueso heterotopico.21,27
Los valores de excresion en 24 hs. de PG E2 en ptes. con trauma medular están y permanecen aumentados hasta que el centellograna con TC99 se estabiliza.
Factores de riesgo
No hay una asociación por raza o género, a pesar de haber una incidencia levemente mayor en pacientes varones jóvenes.13,19,20
También se sugiere una predisposición genética a través del antígeno linfocítico humano HLA, sobre todo el HLA B18 y B27.11,31
Los pacientes que están más tiempo inmovilizados, con periodos prolongados en coma, aquellos que usan respiradores mecánicos como asistencia respiratoria o con múltiples fracturas óseas tienen mayor probabilidad de tener OH.
Diagnóstico
Se basa principalmente en signos clínicos y en su presunción. Pueden aparecer en forma temprana, a las 3 semanas, o en forma tardía alrededor de las 12 semanas luego de un trauma músculo esquelético, trauma medular u otro evento precipitante.32
Los síntomas tempranos deben ser diferenciados de artritis, tromboflebitis, TVP, celulitis, hematoma, síndrome de dolor regional complejo, artritis séptica y tumores de partes blandas.19,28,29,32
La elevación en la FA sirve para distinguir la OHN de otros procesos inflamatorios, ya que esta muy elevada durante la osteogénesis activa.16
La ecografía de partes blandas locales sirve para diferenciar OH de Trombosis venosa profunda, tumores de partes blandas o infección.33
Para distinguir OHN de procesos reumáticos agudos se pueden realizar análisis de líquido sinovial, el cual en caso de ser una OHN tiene bajo conteo de GB, pocos PMN, alto contenido en proteínas, baja viscosidad y sin cristales.21,33
Exámenes de laboratorio
La determinación aislada de calcio en plasma o en orina tiene poca válidez en el diagnóstico y monitoreo de la OH. La elevación de la FA refleja la fase inicial inflamatoria, pero es poco específica. Se encuentra aumentada hasta 7 semanas antes de la aparición de síntomas clínicos.10
Las isoenzimas SAP (secreted aspartyl proteinasas) son marcadores sensibles, pero no específicos de OH. Estas enzimas pueden ser detectadas y separadas por electroforesis y reflejan la actividad del proceso de osificación.8,34
La determinación de la excreción del metabolito del colágeno urinario sirve como indicador de la degradación del colágeno. Aumenta en OH.
Hay aumento de la excreción urinaria de PG E2 en 24 hs., el cual se mantiene hasta la maduración total de la OH. Sirve para diagnóstico temprano.35
La concentración urinaria de la hidroxiprolina, que es otro metabolito del colágeno, sirve como medidor de actividad en casos de OH.21 Como también se dan en cualquier caso de lesión medular con lesión motora no es muy efectivo como parámetro.
Diagnóstico por imágenes
En los estadíos tempranos la formación ósea consiste en osteoide que muestra una alta captación en estudios radionucleares, por lo que se detecta en la fase tres (fase ósea estática) de la centellografía con Tc99.10,21
La fase uno (fase de flujo sanguíneo dinámica) de la centellografia detecta las áreas de aumento del flujo sanguíneo, entonces puede detectar el proceso temprano inflamatorio de la OH. La fase dos (fase del pool sanguíneo estático) y la fase tres (fase ósea estática) pueden detectar OH tan temprano como 2,5 semanas luego del trauma medular y la fase tres permanece positiva por 1 a 4 semanas.
La centellografía se normaliza en tanto la OH madura, usualmente dentro de 6-18 meses luego de la aparición clínica.
La centellografía es mas sensible que la Rx para el diagnóstico temprano de OH, pero la Rx es más específica. La centellografía a veces no distingue entre OH, inflamación, trauma, tumor o metástasis, las cuales todas tienen aumento de la actividad osteoclástica y por lo tanto hipercaptan con la centellografía.10,33,36
Para el moniteoreo de la maduración de la OH la centellografia es muy sensible por lo que es el estudio de elección.
El diagnóstico ecográfico de la OH depende de la edad de la lesión, la tasa de formación de hueso y el grado de mineralización.
La ecografía de comienzo muestra una masa hipoecoica elongada, focal y es inespecífica, ya que se parece a desgarros, abscesos o tumores de partes blandas. Cuando comienza a ver desarrollo de patrón centrípeto, se ven zonas intermedias con focos de islas ecodensas. Estas luego confluyen y se ven como el fenómeno de zona descripto previamente. A las 4-6 semanas cuando el hueso está mineralizado, se comporta como cortical, la ecografía se refleja y es el momento de verla por radiografías simples.33,37,38
El signo radiográfico mas temprano de OH es un aumento de la densidad de las partes blandas peri-articulares debido al edema local.
Gradualmente esta imagen tiene densidades focalizadas debido a los precipitados cálcicos. El proceso de maduración marca un aumento de la delineación de la masa de Partes Blandas y la formación de cortical y trabéculas óseas. La masa ósea ectópica muestra grados variables de demineralización, pero las superficies articulares permanecen sin afectación.
La OH se hace evidente en la radiografía en cuanto la acumulación de minerales lleva 2 a 6 semanas luego de la fase tres positiva del centello.
El promedio de signos radiográficos positivos es entre 1 a 10 semanas (promedio 6 semanas) de los primeros síntomas clínicos. En pacientes asintomáticos, a veces hay signos en las radiografías a las 4-5 semanas.
La radiografía sirve para monitorear la OH solo cuando hay cambios entre una y otra imagen, los elementos inmaduros son tapados u obscurecidos por el hueso maduro.
No se considera a la radiografia como método para evaluar la madurez de la OH, como tampoco para determinar recurrencia o reactivación.39,40
La Tomogragia Axial Computada (TAC) muestra una mejor visualización del hueso ectópico en relación a las Partes Blandas. Es especialmente útil en el desarrollo del plan quirúrgico sobre todo TAC 3D, para tener claro la via de abordaje.41
La RMN es el mejor estudio para determinar la extensión del edema de partes blandas, pero no tiene ningún papel en el diagnóstico temprano de las OH. No permite diferenciarlo de otrtos procesos inflamatorios.39
Osificación Heterotópica luego de trauma craneo-encefálico o medular
La OHN es una complicación frecuente en pacientes con trauma craneo encefálico o lesión de medula espinal.
La incidencia es del 10-53%, dependiendo del diseño del estudio, los métodos de detección (rx o clínico) y los criterios de diagnósticos usados.1,8,10
En las mielopatías no-traumáticas, la OH tiene una incidencia menor, entre 6-15%.
La incidencia en niños es baja del 3-10%. Tiene además la característica de ser menos sintomática y con mayor tendencia a la regresión espontánea, lo mismo que en adultos muy jóvenes.42
El espectro clínico va desde un hallazgo radiográfico hasta una limitación severa o completa (anquilosis) del rango de movimiento de algunas/s articulaciones periféricas. En muchos casos la extensión radiográfica de la lesión es minima, pero en 20-30% de los ptes. con lesión de medula espinal es clínicamente significativa, con gran limitación del movimiento, mientras que el 3-8% de estos pacientes desarrollan anquilosis.2,3,5,10,32,38,42,43
La OHN siempre se desarrolla por debajo del nivel de lesión medular, siendo el lugar más frecuente la cadera (70-97%). Otros segmentos corporales como rodilla, codo, hombro, mano y columna, en orden decreciente, pueden estar involucradas.
En forma incidental ha sido reportada en cirugía de partes blandas el pacientes con lesión medular.22,44
El grado de gravedad de la lesión medular parece ser mas importante que el nivel de lesión. Catz A et al.45 no encuentra relación entre diagnóstico por radiografía de OHN y severidad de déficit motor, mientras que otros autores sugieren que lesiones transversas completas están más asociadas a OHN que las lesiones parciales, con tasa de riesgo relativos (RR) entre 2,0-4,2.1,3,8
Asi mismo, la OH es menos frecuente (< 5%) en pacientes con lesiones lumbo-sacras que mantienen o recuperan la capacidad para ambular.3
Otros factores que se asocian son: úlceras por decúbito, infección del tracto urinario (ITU) o cálculos renales, trombosis venosa profunda (TVP), espasticidad severa y micro trauma local.3,6,44,45
Ejemplo: un área de daño de partes blandas debido a una úlcera por decúbito con edema posterior predispone al desarrollo de OH. Por otra parte, la OHN favorece el desarrollo de escaras por decúbito debido a que el paciente pierde la capacidad para moverse y la forma en que distribuye la descarga de peso al estar sentado, las escaras son del lado opuesto al lado con OHN.
Los pacientes en fase aguda de un trauma medular tienen un estado de hipercoagulabilidad y están con mayor riesgo de desarrollo de fenómenos tromboembólicos. El riesgo relativo (RR) de TVP y OHN es de 1,8-2,0, comparados con pacientes sin TVP.
Existe un 5,3% de co-incidencia de TVP y OHN. En general la TVP se diagnóstica primero, y la OHN se desarrolla del mismo lado que la TVP.46
De cualquier manera la relación precisa patofisiológica entre TVP y OHN no está bien establecida.46
La relación con la espasticidad está más comprobada. La OHN se ve mas en pacientes con espasticidad y es mayor con espasticidad severa (RR 0,17-2,0).6
La OH es rara en miembros flácidos no afectados por espasticidad.6,36
El rol de micro-trauma se debe en general a stress mecánico del aparato músculo-tendinoso por movilización pasiva vigorosa10 o por pérdida de movilidad y disbalance muscular, causando picos de presión en las partes blandas. Este trauma mecánico local provoca una respuesta inflamatoria que libera factores estimulantes de los osteoblastos. Hay estudios que relacionan el intervalo de tiempo entre la lesión medular y el comienzo de los ejercicios de movilización pasiva con el desarrollo de OHN.
Según Daud et al.47 la OHN clínicamente aparente solo ocurre cuando los ejercicios son demorados más de 7 días desde el traumatismo. Lo mismo ocurre con la movilización pasiva agresiva, ya que también favorece la OHN.
El desarrollo de la OH es extra-articular y ocurre fuera de la cápsula articular.
A pesar que puede desarrollarse hasta varios años luego de la lesión medular, en general se diagnóstica entre 1 a 6 meses post-lesión con un pico de incidencia a los 2 meses.48 Aunque la OHN puede empezar bastante antes de los síntomas clínicos, los signos iniciales se hacen evidentes dentro de las tres primeras semanas.3,44 Los hallazgos clínicos más importantes son limitación del rango de movimiento e inflamación peri-articular debido al edema intersticial de las partes blandas.1,35,36
En pacientes con preservación de la sensibilidad del dolor, el primer síntoma puede ser dolor del área afectada.35 Muchas veces hay eritema peri-articular, flogosis con aumento de la temperatura local y fiebre. Esto en general provoca aumento de la espasticidad.
Tanto la pérdida de movimiento articular de la cadera como la espasticidad lleva a la pérdida de la posibilidad de sentarse, úlceras por decúbito y dolores por la posición.
Es muy infrecuente, pero está reportado, la compresión de estructuras neurovasculares por la OH.46
Caso 1
Paciente de sexo masculino de 31 años de edad, 93 kg, 1,85 m. Sufre caída de 3 mts con lesión cervical C6, paraplejía y se interna en unidad de cuidados intensivos (UTI), con asistencia respiratoria. Consulta al año con mejoría de la lesión cervical, pero refiere rigidez completa de cadera (Anquilosis), dificultad para vestirse, sentarse e higienizarse (figs. 1 a 5).
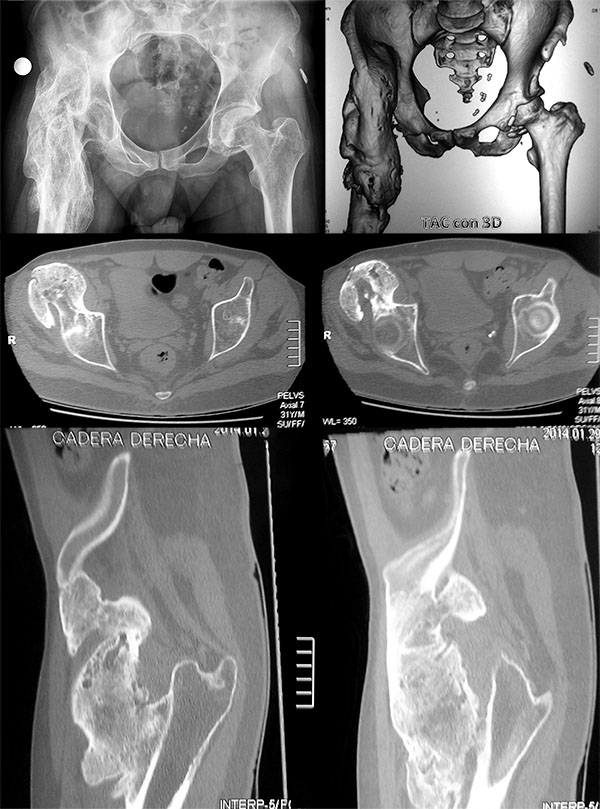
Figura 1: Radiografía y TAC donde se observa la OH desde el fémur proximal hasta la región proximal acetabular.

Figura 2: Posición de la cadera en abducción y en rotación externa.

Figura 3: Imagen intraoperatoria de la calcificación antes de su resección.
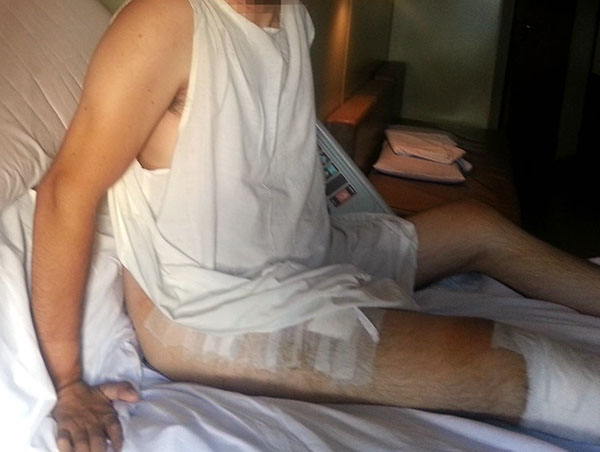
Figura 4: Foto post operatoria donde se observa la flexión de cadera.
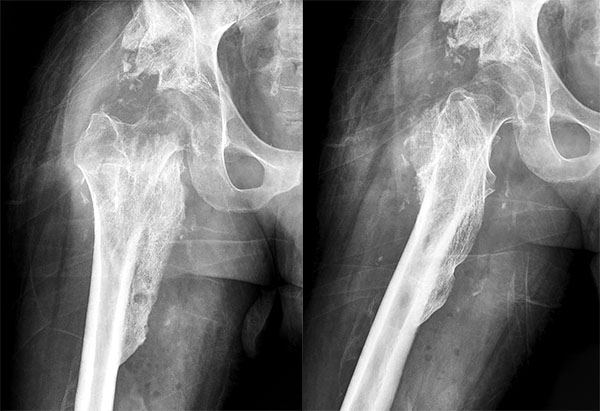
Figura 5: Rx post quirúrgica donde se observa la resección de la OH quedando la cadera libre.
Caso 2
Paciente de sexo masculino de 28 años de edad, 70 kg, 1,72 m. Sufre accidente en moto. Trauma severo craneo encefálico y se interna en unidad de cuidados intensivos (UTI), en asistencia respiratoria durante 20 días. Consulta al 5 mes por rigidez completa de cadera (Anquilosis), dificultad para vestirse, sentarse e higienizarse. Presenta imposibilidad para deambular (fig. 6).
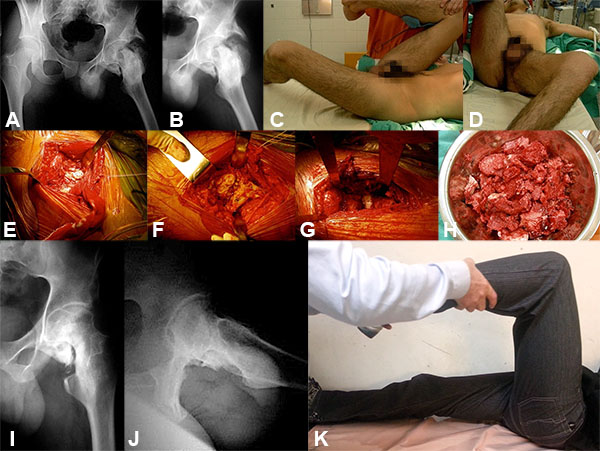
Figura 6: A-B) RX de ambas caderas F y cadera izquierda P donse se observa la OH que provoca la anquilosis de la misma. C-D) Posición de la cadera en abducción, rotación externa máxima y 30º de flexión. e-f) Imagen intraoperatoria de la calcificación antes de su resección. G-H) Imagen intraoperatoria luego de la resección de la OH y la cantidad de hueso hectópico resecado. I-J) Rx post quirúrgica donde se observa la resección de la OH quedando la cadera libre. K) Examen físico post quirúrgico. Flexión de cadera conservada y correxión de la rotación externa y abducción.
Osificación Heterotópica luego de RTC
La OH luego del RTC es más frecuente en hombres que en mujeres.15,49 Los pacientes con historia de OH en la cadera contralateral tienen un riesgo aumentado de padecer OH (hasta un 90% sin tratamiento). Los hombres con osteoartrosis bilateral hipertrófica también presentan un riesgo aumentado. La espondilitis anquilosante, hiperostosis esquéletica idiopática difusa son entidades con mayor riesgo de OH.16
Los abordajes de cadera juegan un rol en cuanto a las OH. Los abordajes anteriores tipo Smith-Petersen, y laterales como el abordaje de Hardinge50 presentan mayor incidencia de OH que el abordaje posterolateral de cadera.51 En el abordaje anterolateral de cadera la OH se puede observar en el 29% de los pacientes.52
La OH es más frecuente con el uso de tallos no cementados que con los tallos cementados, esto se debería a la propagación de partículas óseas producidas durante en fresado femoral.15,53
Se utiliza la clasificación de Brooker54 (fig. 7) para estadificar las OH post-RTC.
A pesar de poder realizar el diagnósco mediante evaluación radiográfica, algunos signos y síntomas tempranos nos pueden indicar la posibildad de esta complicación. Puede presentarse como dolor persistente diferente al dolor habitual postquirúrgico. Booker clasifica las OH en 4 tipos.
- Brooker 1: islotes óseos aislados dentro de los tejidos blandos (fig. 8).
- Booker 2: osificación que se proyecta desde el fémur o pelvis por al menos más de 1 cm de distancia entre las superficies opuestas (fig. 9).
- Brooker 3: osificación que se proyecta desde el fémur o pelvis con menos de 1 cm de distancia entre las superficies opuestas (fig. 10).
- Brooker 4: osificación que hace un puente completo. Anquilosis de la cadera (fig. 11).
Generalmente, las OH Booker 1 y 2 no generan gran sintomatología ni pérdida de la movilidad de la cadera. En las calcificaciones Brooker 3 y 4 podemos observar pérdida en el rango de movimiento de la cadera. La irritación del nervio ciático es rara luego de la formación de OH, sobre todo en cirugía primaria. La inestabilidad protésica es otra posible complicación debido al impingement que puede producir la formación ósea y pérdida del rango de movilidad. El tiemo de cirugía y la pérdida sanguinea son variables contradictorias. En un estudio retrospectivo de 178 casos, Toom et al.55 encontraron 1.9 veces mayor incidencia de OH luego de RTC, donde el tiempo quirúrgico fue mayor a 100 min comparado con los RTC de menor duración. Sin embargo, no encontraron relación entre la incidencia de OH y la transfusión sanguínea ni del tipo de anestesia.49

Figura 7: Gráfico y explicación de la clasificación de Brooker de Brooker AF, Bowerman JW, Robinson RA, Riley LH Jr: Ectopic ossification following total hip replacement: Incidence and a method of classification. J Bone Joint Surg Am 1973;55:1629- 1632.

Figura 8: Brooker 1.
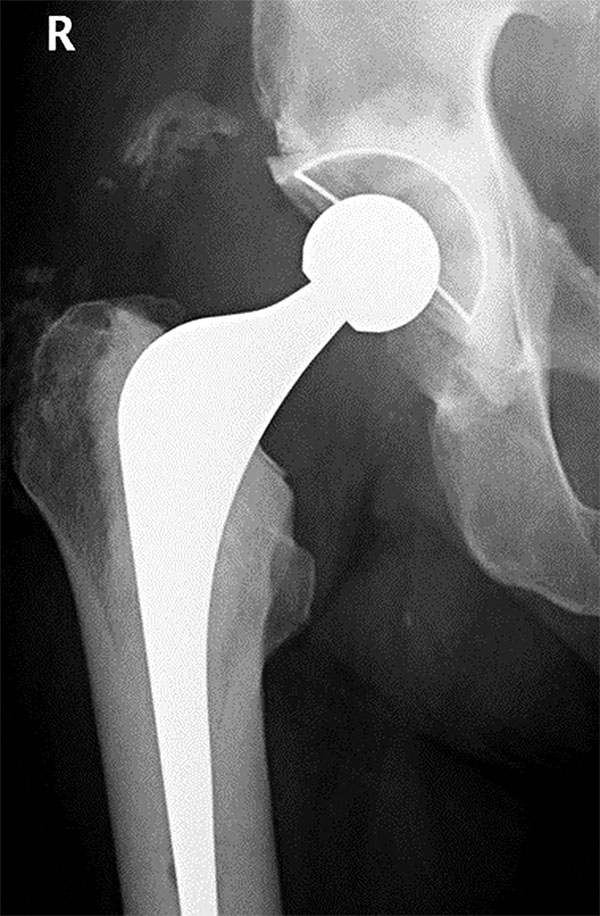
Figura 9: Brooker 2.

Figura 10: Brooker 3.
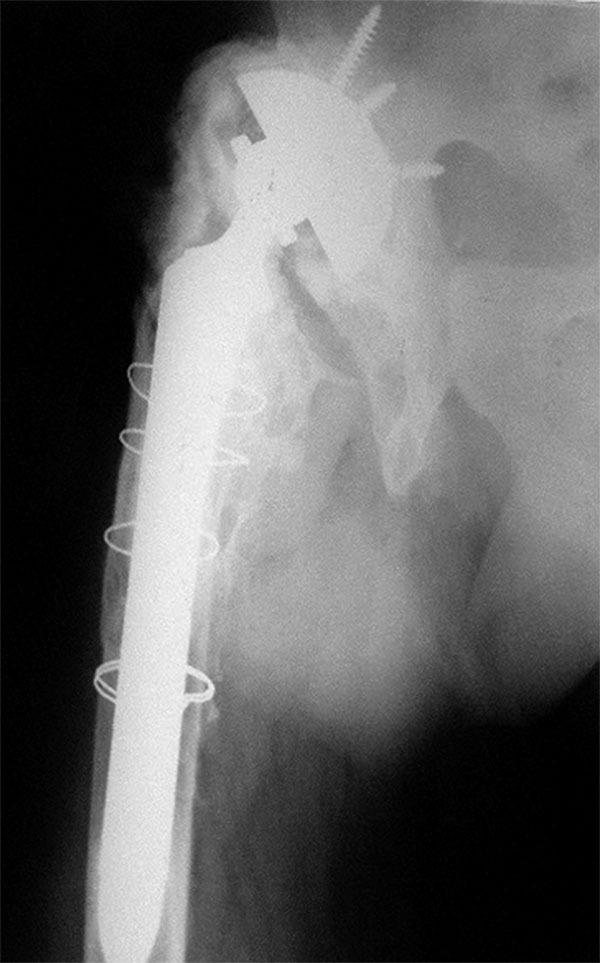
Figura 11: Brooker 4.
Osificación Heterotópica luego quemadura severa
La incidencia de OH en los quemados es entre 1-3%. Este tipo de OH se produce generalmente alrededor de las articulaciones mayores. La cadera, hombro y codo son las articulaciones más comunmente afectadas.
Los factores de riesgo en este grupo poblacional son:20,56,57 largo periodo de inmovilización y hospitalización, porcentaje del cuerpo quemado, pacientes ventilados, que requirieron gran cantidad de cirugías (desbridamiento, escarectomías) .
Los signos y síntomas incluyen disminución del rango de movilidad, dolor a la movilización articular, inflamación local, debilidad muscular. Puede ser difícil diferenciarlo en la presencia de una escara que involucra la zona. Cuando la disminución en el rango de movilidad o se produce una neuropatía que afecta la actividad de la vida diaria está indicada la resección quirúrgica de la OH.
Caso 3
Paciente de 10 años que sufre a los 6 años quemadura del 70% del cuerpo.
Presenta ambas caderas fijas en aducción, rodillas con movilidad conservada y deformidad en ambos pies. Se realiza un primer tiempo quirúrgico donde se corrigieron los pies para que fueran plantígrados (fig. 12).
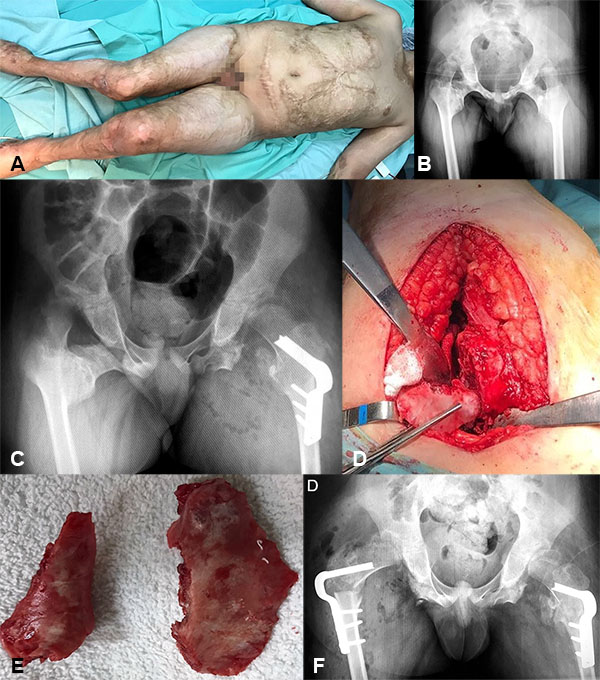
Figura 12: A) Imagen que muestra la severidad de las quemaduras y la posición de ambas caderas. B) Se oserva OH en ambas caderas, las cuales se encuentran en 170º de valgo. C) Rx post quirúrgica de la resección de la OH en cadera izquierda y la realización de una osteotomia varizante y fijación con clavo placa. D-E) Imagen intraoperatoria de la OH. F) Rx post quirúrgica de la resección de la OH en cadera derecha y la realización de una osteotomia varizante y fijación con clavo placa.
TRATAMIENTO
El tratamiento de la OH depende de la severidad y extensión del hueso ectópico y la incapacidad funcional que produce. El exámen clínico nos permite valorar la movilidad articular. Los pacientes con espasticidad persistente o pobre recuperación funcional tienen un alto índice de recidiva de la OH y pobre movilidad articular. El tratamiento debe comenzar con fisioterapia y movilización articular para luego pasar por tratamiento médico, radioterapia o tratamiento quirúrgico
Fisioterapia
En los pacientes con OH, la fisioterapia cuidadosa ha resultado beneficiosa. Esto incluye asistencia en los ejercicios de movilidad y cuidadosa elongación muscular. Se debe tener cuidado de realizar los movimientos sin producir dolor dado que esto puede exacerbar la OH. La fisioterapia generalmente se combina con otra forma de tratamiento para obtener un máximo beneficio terapéutico.
Tratamiento Médico
El objetivo del tratamiento médico es la de prevenir la formación de hueso ectópico luego de un trauma o la de prevenir la recurrencia luego de una escisión quirúrgica.
Analgesicos No Esteroides (AINE)
Los AINEs en particular la Indometacina,58 han probado su beneficio en la prevención de la formación de hueso ectópico tanto luego de un RTC como en los pacientes con trauma cráneo encefálico o lesión medular. Otros estudios han publicado los beneficios de los inhibidores Cox2, en particular Meloxicam.59
El conocimiento básico sobre el tratamiento profiláctico de la formación ectópica de hueso con AINEs viene de estudios con animales y en pacientes operados con RTC. Los AINEs inhiben el proceso de inflamación y suprime la proliferación de células mesenquimáticas.36 Al inhibir la liberación de protaglandinas reduce la estimulación de las fases formativas y reabsortivas de la remodelación ósea. Además, inhiben la diferenciación de células mesenquimáticas a células osteogénicas, disminuyendo la osificación ectópica.
Banovac et al.58 en un estudio clínico randomizado prospectivo, doble-ciego, controlado con placebo, en pacientes con lesión medular compara 2 grupos: grupo 1 con indometacina 75, grupo 2: placebo por 3 semanas, promedio 20 días post lesión. Grupo 2 (placebo) mostró mayor incidencia de OH (65%) comparado con grupo 1 (indometacina) (25%). En el grupo 1, el comienzo de síntomas fue más tardío y los síntomas inflamatorios más leves. Concluye que la indometacina usada durante los primeros 2 meses luego del trauma espinal es un método efectivo de prevención de OH.
Etidronato Disódico
Una vez hecho el diagnóstico los pacientes pueden tratarse con difosfonatos. Los difosfonatos son análogos estructurales de los pirofosfatos inorgánicos que juegan un rol importante en el metabolismo fosfo-cálcico. El EHDP se une fuertemente a la hidroxiapatita (HA) bloqueando la transformación de fosfato cálcico amorfo en cristales de HA, sin inhibir la formación de matriz ósea.60
En general se usa en etapas tempranas de la OH, una vez hecho el diagnóstico.7
EDHP 20 mg/kg/dia x 2 semanas, seguidos x 10 mg/kg/dia las siguientes 10 semanas.
Esto puede demorar el proceso de mineralización pero no detenerlo en forma completa.10,60
Está descripta que al finalizar el tratamiento con EHDP, la matriz ósea ya formada se mineraliza sin ningún tipo de inhibición, llamándose “osificación por rebote”.36
Radioterapia
Se supone que destruye el proceso de diferenciación de células mesenquimales pluripotenciales en osteoblastos.29
También disminuye la percepción del dolor asociado a la inflamación de las partes blandas alrededor de la OH, o produce la ablación de los receptores del dolor.
En un estudio61 de 20 pacientes con radioterapia (RT) de bajo campo con 10 Gy en fracciones únicas de 2 a 2,5 Gy, muestra que es efectivo para la prevención así como para disminuir la recurrencia. Las complicaciones de la RT son: retraso en cierre de herida, consolidación ósea, osteonecrosis y sarcoma inducido por radiación.61,62
La Radioterapia ha sido utiliazada en forma exitosa para prevenir o tratar la OH. Coventry et al.63 reportaron la eficacia de la radioterapia en la prevención de OH luego de un RTC.
Healy, W et al.64 comparó irradiación con dosis única de 7Gy con 5,5Gy. Éste fue un analisis retrospectivo de 107 RTC en riesgo de desarrollar OH luego de la cirugía. Todos los pacientes recibieron el tratamiento los 3 días posteriores a la cirugía. Desrrollaron OH el 10% de los pacientes que recibieron 7Gy y el 63% de los que recibieron 5,5Gy (p 0,03). Los autores concluyen que 5,5 Gy no es una dosis suficiente como profilaxis de OH.
La radioterapia preoperatoria y postoperatoria tienen una similar eficacia en cuanto a la prevención y recidiva de la OH.29
Reseccion quirúrgica
Realizar la cirugía para incrementar la movilidad articular o cambiar la posición del miembro también requiere el uso de imagénes. Si la resección quirurgica se retrasa hasta que la OH ha alcanzado la maduración (menos metabólicamente activa y con menor posibilidad de formación ósea), entonces las complicaciones intraoperatorias como hemorragia y recurrencia de la OH son menos frecuentes. Garland et al.36 recomienda una guía para la resección quirúrgica de la OH dependiendo de su etiologia: 6 meses luego de la formacion de OH por un trauma musculoesquelético directo, 1 año luego de una lesión medular y 1,5 años posterior a un trauma craneo encefálico.
El candidato ideal para la resección quirúrgica de la OH es el paciente sin dolor, ni inflamación, niveles de fosfatasa alcalina normal y fase 3 de la centellografía indicando OH madura.
La resección quirúrgica es considerada cuando la OH trae limitaciones de la función o provoca áreas de presiones cutáneas que puedan provocar escaras por decúbito.
Hay reportes de severas complicaciones y pobres resultados, estas incluyen infección profunda (2-5%), infección superficial (7-38%), hemorragia postoperatoria (5-38%) que requieran tranfusiones múltiples (9-83%), fractura intra-operatoria de cabeza femoral (5%) y fractura espontánea post-operatoria (3-16%).7,21,65
La tasa de recurrencia es alta, esto depende de cómo se define y el periodo de seguimiento utilizado.
Tasa de recurrencia del 82-100% en pacientes operados por OHN por lesión medular,7,65 aunque ésta será clínicamente relevante es sólo el 17-58% de los casos.7,35,42
Esta recurrencia se da sobre todo si la resección por cirugía se da cuando todavía no esta madurado la OH (fase 1 o 2 de la centellografia).
El tiempo de espera aconsejado es de 12-18 meses entre el diagnóstico de OHN y la resección, aunque no hay estudios que claramente asi lo demuestren.
Para la prevención de la recurrencia post-cirugía esta descripta la RT y la administración de indometacina.
Debido a la alta tasa de recurrencia hay que tratar de considerar todos los métodos terapéuticos posibles para evitar que se repita el proceso.
BIBLIOGRAFÍA
- Dejerne A CA. Para-osteo-arthropathies des paraplégiques par lésion médullaire; étude clinique et radiographique. Ann Med. 1918;5:497.
- Heilbrun N KW. Erosive bone lesions and soft tissue ossifications associated with spinalcord injuries (Paraplegia). Radiology 1947;48(579-593).
- AS A. Bone disturbances in injuries to th espinal cord and cauda equina. Their prevention by ambulation J Bone Joint Surg 1948;30 (A):982-8.
- Liberson. Soft tissue calcifications in cord lesions. J Am Med Assoc 1953;152((11)):1010-3.
- L D. Heterotopic ossification of the hip after spinal cord injury. Chin Med J (Engl) 1998;111:1099-104.
- Lal S, Hamilton BB, Heinemann A, Betts HB. Risk factors for heterotopic ossification in spinal cord injury. Arch Phys Med Rehabil. 1989;70(5):387-90.
- Stover SL NK, Tulloss JR. Experience with surgical resection of heterotopic bone in spinal cord injury patients. Clin Orthop. 1991;263:71-4.
- Wittenberg RH, Peschke U, Bötel U. Heterotopic ossification after spinal cord injury. Epidemiology and risk factors. J Bone Joint Surg Br. 1992;74(2):215-8.
- EVANS EB, SMITH JR. Bone and joint changes following burns; a roentgenographic study; preliminary report. J Bone Joint Surg Am. 1959;41-A(5):785-99.
- Garland DE. Clinical observations on fractures and heterotopic ossification in the spinal cord and traumatic brain injured populations. Clin Orthop Relat Res. 1988(233):86-101.
- Minaire P, Betuel H, Girard R, Pilonchery G. Neurologic injuries, paraosteoarthropathies, and human leukocyte antigens. Arch Phys Med Rehabil. 1980;61(5):214-5.
- Connor JM, Woodrow JC, Evans DA. Histocompatibility antigens in patients with ectopic ossification due to fibrodysplasia ossificans progressiva. Ann Rheum Dis. 1982;41(6):646-7.
- Feldman G, Li M, Martin S, Urbanek M, Urtizberea JA, Fardeau M, et al. Fibrodysplasia ossificans progressiva, a heritable disorder of severe heterotopic ossification, maps to human chromosome 4q27-31. Am J Hum Genet. 2000;66(1):128-35.
- Ahrengart L, Lindgren U. Functional significance of heterotopic bone formation after total hip arthroplasty. J Arthroplasty. 1989;4(2):125-31.
- Ritter MA, Vaughan RB. Ectopic ossification after total hip arthroplasty. Predisposing factors, frequency, and effect on results. J Bone Joint Surg Am. 1977;59(3):345-51.
- DeLee J, Ferrari A, Charnley J. Ectopic bone formation following low friction arthroplasty of the hip. Clin Orthop Relat Res. 1976(121):53-9.
- Sundaram NA, Murphy JC. Heterotopic bone formation following total hip arthroplasty in ankylosing spondylitis. Clin Orthop Relat Res. 1986(207):223-6.
- Dai LY, Zhou WJ. [Ectopic ossification following total hip replacement]. Zhonghua Wai Ke Za Zhi. 1992;30(10):599-602.
- Firoozabadi R, O’Mara TJ, Swenson A, Agel J, Beck JD, Routt M. Risk factors for the development of heterotopic ossification after acetabular fracture fixation. Clin Orthop Relat Res. 2014;472(11):3383-8.
- Evans EB. Heterotopic bone formation in thermal burns. Clin Orthop Relat Res. 1991(263):94-101.
- Pape HC, Marsh S, Morley JR, Krettek C, Giannoudis PV. Current concepts in the development of heterotopic ossification. J Bone Joint Surg Br. 2004;86(6):783-7.
- Sakellariou VI, Grigoriou E, Mavrogenis AF, Soucacos PN, Papagelopoulos PJ. Heterotopic ossification following traumatic brain injury and spinal cord injury: insight into the etiology and pathophysiology. J Musculoskelet Neuronal Interact. 2012;12(4):230-40.
- Jensen LL HE, Little J, Brooke MM. Neurogenic heterotopic ossi fi cation. Am J Phys Med Rehabil. 1987(66):351 – 63.
- Pedersen NW, Kristensen SS, Schmidt SA, Pedersen P, Kjaersgaard-Andersen P. Factors associated with heterotopic bone formation following total hip replacement. Arch Orthop Trauma Surg. 1989;108(2):92-5.
- ACKERMAN LV. Extra-osseous localized non-neoplastic bone and cartilage formation (so-called myositis ossificans): clinical and pathological confusion with malignant neoplasms. J Bone Joint Surg Am. 1958;40-A(2):279-98.
- Ritter MA, Galley M. Heterotopic bone formation following resurfacing total hip arthroplasty. HSS J. 2011;7(1):41-3.
- Chalmers J, Gray DH, Rush J. Observations on the induction of bone in soft tissues. J Bone Joint Surg Br. 1975;57(1):36-45.
- Buring K. On the origin of cells in heterotopic bone formation. Clin Orthop Relat Res. 1975(110):293-301.
- Balboni TA, Gobezie R, Mamon HJ. Heterotopic ossification: Pathophysiology, clinical features, and the role of radiotherapy for prophylaxis. Int J Radiat Oncol Biol Phys. 2006;65(5):1289-99.
- Sullivan MP, Torres SJ, Mehta S, Ahn J. Heterotopic ossification after central nervous system trauma: A current review. Bone Joint Res. 2013;2(3):51-7.
- Larson JM, Michalski JP, Collacott EA, Eltorai D, McCombs CC, Madorsky JB. Increased prevalence of HLA-B27 in patients with ectopic ossification following traumatic spinal cord injury. Rheumatol Rehabil. 1981;20(4):193-7.
- Cipriano CA, Pill SG, Keenan MA. Heterotopic ossification following traumatic brain injury and spinal cord injury. J Am Acad Orthop Surg. 2009;17(11):689-97.
- Shehab D, Elgazzar AH, Collier BD. Heterotopic ossification. J Nucl Med. 2002;43(3):346-53.
- Kjaersgaard-Andersen P, Pedersen P, Kristensen SS, Schmidt SA, Pedersen NW. Serum alkaline phosphatase as an indicator of heterotopic bone formation following total hip arthroplasty. Clin Orthop Relat Res. 1988(234):102-9.
- Wharton GW, Morgan TH. Ankylosis in the paralyzed patient. J Bone Joint Surg Am. 1970;52(1):105-12.
- Garland DE. A clinical perspective on common forms of acquired heterotopic ossification. Clin Orthop Relat Res. 1991(263):13-29.
- Popken F, König DP, Tantow M, Rütt J, Kausch T, Peters KM. [Possibility of sonographic early diagnosis of heterotopic ossifications after total hip-replacement]. Unfallchirurg. 2003;106(1):28-31.
- Cassar-Pullicino VN, McClelland M, Badwan DA, McCall IW, Pringle RG, el Masry W. Sonographic diagnosis of heterotopic bone formation in spinal injury patients. Paraplegia. 1993;31(1):40-50.
- Laurin NR, Powe JE, Pavlosky WF, Driedger AA. Multimodality imaging of early heterotopic bone formation. Can Assoc Radiol J. 1990;41(2):93-5.
- Zeanah WR, Hudson TM. Myositis ossificans: radiologic evaluation of two cases with diagnostic computed tomograms. Clin Orthop Relat Res. 1982(168):187-91.
- Amendola MA, Glazer GM, Agha FP, Francis IR, Weatherbee L, Martel W. Myositis ossificans circumscripta: computed tomographic diagnosis. Radiology. 1983;149(3):775-9.
- Garland DE, Shimoyama ST, Lugo C, Barras D, Gilgoff I. Spinal cord insults and heterotopic ossification in the pediatric population. Clin Orthop Relat Res. 1989(245):303-10.
- Ohlmeier M, Suero EM, Aach M, Meindl R, Schildhauer TA, Citak M. Muscle localization of heterotopic ossification following spinal cord injury. Spine J. 2017.
- LIBERSON M. Soft tissue calcifications in cord lesions. J Am Med Assoc. 1953;152(11):1010-3.
- Catz A, Snir D, Groswasser Z, Mendelson L, Solzi P. Is the appearance of periarticular new bone formation related to local neurological disability? Paraplegia. 1992;30(5):361-5.
- Colachis SC, Clinchot DM. The association between deep venous thrombosis and heterotopic ossification in patients with acute traumatic spinal cord injury. Paraplegia. 1993;31(8):507-12.
- Daud O, Sett P, Burr RG, Silver JR. The relationship of heterotopic ossification to passive movements in paraplegic patients. Disabil Rehabil. 1993;15(3):114-8.
- Lugones A AB. Osificación heterotópica bilateral de cadera. A propósito de un caso. Rev Asoc Argent Ortop Traumatol. 2009; 74: 268-72.
- Cohn RM, Schwarzkopf R, Jaffe F. Heterotopic ossification after total hip arthroplasty. Am J Orthop (Belle Mead NJ). 2011;40(11):E232-5.
- Lopreite F AF, Del Sel H. Complicaciones tempranas en la artroplastia total de cadera por vía anterolateral transglútea directa Rev Asoc Argent Ortop Traumatol. 2006;72:.75-81.
- Nuñez L BM, Farfalli G, Comba F, Piccaluga F. Complicaciones relacionadas con el abordaje transtrocantéreo y posterolateral en la artroplastia total de cadera primaria Rev Asoc Argent Ortop Traumatol. 2007; 72: 338-44.
- Harwin SF. Trochanteric heterotopic ossification after total hip arthroplasty performed using a direct lateral approach. J Arthroplasty. 2005;20(4):467-72.
- Maloney WJ, Krushell RJ, Jasty M, Harris WH. Incidence of heterotopic ossification after total hip replacement: effect of the type of fixation of the femoral component. J Bone Joint Surg Am. 1991;73(2):191-3.
- Brooker AF BJ, Robinson RA, Riley LH Jr. Ectopic ossification following total hip replacement. Incidence and a method of classification . J Bone Joint Surg Am 1973.
- Toom A, Haviko T, Rips L. Heterotopic ossification after total hip arthroplasty. Int Orthop. 2001;24(6):323-6.
- Gaur A, Sinclair M, Caruso E, Peretti G, Zaleske D. Heterotopic ossification around the elbow following burns in children: results after excision. J Bone Joint Surg Am. 2003;85-A(8):1538-43.
- Peterson JR, De La Rosa S, Sun H, Eboda O, Cilwa KE, Donneys A, et al. Burn injury enhances bone formation in heterotopic ossification model. Ann Surg. 2014;259(5):993-8.
- Banovac K, Williams JM, Patrick LD, Haniff YM. Prevention of heterotopic ossification after spinal cord injury with indomethacin. Spinal Cord. 2001;39(7):370-4.
- Legenstein R, Bösch P, Ungersböck A. Indomethacin versus meloxicam for prevention of heterotopic ossification after total hip arthroplasty. Arch Orthop Trauma Surg. 2003;123(2-3):91-4.
- Garland DE, Alday B, Venos KG, Vogt JC. Diphosphonate treatment for heterotopic ossification in spinal cord injury patients. Clin Orthop Relat Res. 1983(176):197-200.
- Sautter-Bihl ML, Liebermeister E, Nanassy A. Radiotherapy as a local treatment option for heterotopic ossifications in patients with spinal cord injury. Spinal Cord. 2000;38(1):33-6.
- Sautter-Bihl ML, Liebermeister E, Heinze HG, Nanassy A, Stoltze D. [The radiotherapy of heterotopic ossifications in paraplegics. The preliminary results]. Strahlenther Onkol. 1995;171(8):454-9.
- Coventry MB, Scanlon PW. The use of radiation to discourage ectopic bone. A nine-year study in surgery about the hip. J Bone Joint Surg Am. 1981;63(2):201-8.
- Healy WL, Lo TC, DeSimone AA, Rask B, Pfeifer BA. Single-dose irradiation for the prevention of heterotopic ossification after total hip arthroplasty. A comparison of doses of five hundred and fifty and seven hundred centigray. J Bone Joint Surg Am. 1995;77(4):590-5.
- Garland DE, Orwin JF. Resection of heterotopic ossification in patients with spinal cord injuries. Clin Orthop Relat Res. 1989(242):169-76.