REV. ACARO | 2017: Vol. 3, N°2: 48 - 54
El Cotilo no Cementado en Reemplazo Total de Cadera Primario
Jorge O. Galante, Craig Della Valle, Federico J. Burgo, Robert Urban
Department of Orthopaedic Surgery Rush University Medical Center Chicago, IL
Correspondencia:
Jorge O. Galante
jgalante@aol.com
INTRODUCCIÓN
El cotilo no cementado en reemplazo total de cadera es el método de reconstrucción preferido por la gran mayoría de los cirujanos ortopédicos en los Estados Unidos. Cotilos hemisféricos recubiertos de material poroso constituyen el sistema utilizado con mayor frecuencia. En este artículo discutiremos los conceptos básicos de diseño de prótesis de cotilo, nuestra experiencia clínica y los procesos responsables por los fracasos observados a largo plazo.
DISEÑO
Se deben tener en cuenta varios conceptos en relación al diseño de una prótesis de cotilo no cementada: el material de interfas e, el proceso de integración ósea, las características geométricas de la prótesis, el método de fijación inmediata, y otros elementos que forman parte de los diseños contemporáneos.
Hay una serie de materiales porosos y otras superficies biológicamente activas que se han utilizado para la fijación de prótesis. Estos incluyen el plasma spray de titanio, las bolillas sinterizadas de cobalto cromo y de titanio, la fibra de titanio, el Tántalo poroso, otras superficies porosas de titanio de reciente introducción, la hidroxiapatita y las superficies rugosas de titanio.
La formación de hueso en un material poroso requiere un número de prerrequisitos.1
- El primero y el más importante es que el material debe ser absolutamente biocompatible. El titanio con o sin aleación y el tántalo tienen características ideales desde este punto de vista y son muy superiores a las aleaciones de cobalto-cromo o al acero inoxidable.
- Debe existir un contacto íntimo entre la superficie del material poroso y el hueso. Eso se traduce en una técnica quirúrgica e instrumental que permitan crear con precisión las condiciones ideales de contacto.
- Los micromovimientos entre la prótesis y el hueso deben ser mínimos, probablemente hasta un máximo de 100 micrones de desplazamiento relativo entre las dos superficies. La fijación mecánica de la prótesis durante ese periodo inicial es indispensable.
- El diámetro de los poros debe ser adecuado para permitir la invasión y formación ósea. Probablemente el diámetro ideal es entre 250 y 500 micrones de porosidad interconectada, aunque la formación del hueso ocurrirá también con poros más pequeños como en los materiales fabricados con bolillas sinterizadas. Actualmente, la porosidad no es un requisito indispensable para la fijación sin cemento. Integración ósea es también posible en superficies recubiertas con hidroxiapatita y en superficies de titanio rugosas.
- Debe existir una superficie ósea biológicamente activa de suficientes dimensiones como para proveer estabilidad mecánica adecuada.
- Un medio ambiente con características mecánicas que favorezcan este proceso biológico y permitan fijación adecuada y contacto íntimo , tal como lo es el cotilo o la cavidad intramedular del fémur.
El proceso de formación ósea en un material poroso, comienza con la presencia de un coágulo de sangre que se infiltra con células mesenquimatosas osteoprogenitoras. Es posible observar dentro de los primeros diez días la formación de hueso primario sin etapa cartilaginosa. El hueso inmaduro trabecular que se ve en las primeras semanas comienza a transformarse en hueso laminar durante los meses siguientes con evidencia eventual de remodelación de tipo haversiana.
En el año 1971, publicamos nuestros primeros resultados experimentales usando un material poroso fabricado con fibras de titanio sinterizadas para obtener fijación ósea.2 Desde entonces hemos documentado en el laboratorio experimental y en la práctica clínica la biocompatibilidad y la capacidad de este material para permitir la formación del hueso en su estructura porosa y así proporcionar una fijación estable y permanente de una prótesis total. 3-10
Nuestra experiencia clínica en fijación de cotilo sin cemento es exclusivamente con la fibra de titanio. Hay varias publicaciones de nuestro grupo y de otros que relatan resultados excelentes a largo plazo específicamente con relación a la tasa de aflojamiento.11-15 La casuística con otros materiales porosos de titanio o Tántalo es más limitada pero es posible que estas superficies también demuestran fijación duradera a largo plazo.16,17 Los resultados con prótesis recubiertas de material poroso de cobalto-cromo muestran una tasa de aflojamiento más elevada.18, 19 La hidroxiapatita y las superficies de titanio rugoso han dado resultados excelentes en el fémur pero no en el cotilo.20, 21 En el cotilo además del efecto biológico de la oseointegración, la presencia de una estructura porosa tridimensional agrega un elemento mecánico de fijación que puede ser importante dadas las características de deformación del hueso esponjoso pericotiloideo.
Con respecto a la geometría del cotilo, las posibilidades son una prótesis hemisférica, la prótesis de geometría doble (dos radios distintos o elípticos) o el cotilo enroscado. Los mejores resultados a largo plazo son los que se han reportado con la prótesis de forma hemisférica y es la que nosotros consideramos como ideal. La ventaja teórica de la prótesis de geometría doble o la prótesis elíptica es que pueden ofrecer una mejor fijación inmediata ya que sus formas facilitan la impactación. El problema es que aumenta con su uso, el riesgo de fracturas intraoperatorias del cotilo como resultado de esfuerzos excesivos en el cotilo durante su introducción.22 Las prótesis enroscadas han dado resultados variables probablemente en función de distintas superficies pero además carecen de la flexibilidad intraoperatoria necesaria para corregir posibles errores de orientación.23, 24
La fijación inicial de la prótesis es esencial para permitir la formación ósea que proporcionará la fijación a largo plazo. Impactar la prótesis usando una copa de un diámetro 2 milímetros mayor que la última fresa es la técnica que se utiliza con más frecuencia.25 Sin embargo, la impactación no es un elemento esencial para obtener integración ósea si se utiliza otro medio de fijación inicial. Nuestra experiencia original fue obtenida sin impactar la prótesis utilizando tornillos como método de fijación inmediata con excelentes resultados a largo plazo.14
El uso adicional de dos tornillos, aunque no es esencial si la prótesis está bien impactada, agrega un elemento de seguridad y es utilizado con frecuencia en nuestro centro. Tetones, clavos o aletas en la periferia no son necesarios e introducen la posibilidad de que impidan que la prótesis llegue al fondo del cotilo.
Modularidad es en nuestra opinión un concepto indispensable en prótesis de cotilo. La posibilidad de recambio del núcleo de polietileno sin necesidad de hacer una revisión de un anillo metálico bien fijado ofrece una gran ventaja sobre una prótesis monobloque. La modularidad lleva consigo el potencial de desgaste en la superficie no articular del núcleo. Para evitar o disminuir ese problema los diseños contemporáneos incluyen un contacto excelente entre el núcleo y la copa, un mecanismo de captura del núcleo de polietileno adecuado y una superficie lisa o pulida en la cara cóncava de la copa metálica.
Además de los núcleos de polietileno convencionales existen núcleos excéntricos o con paredes extendidas. Si bien pueden ser útiles en circunstancias especiales, por ejemplo en presencia de inestabilidad o en cirugía de revisión, no se deben usar como procedimiento de rutina en cirugía primaria ya que la tasa de aflojamiento aumenta con su uso.26 La posición excéntrica del centro de rotación de la cadera aumenta los esfuerzos de torsión en la interfase hueso-prótesis y la pared extendida aumenta la posibilidad de contacto repetido entre el borde del núcleo y el cuello femoral.
Superficies articulares resistentes al desgaste (polietileno de alta reticulación, metal-metal o cerámica-cerámica) constituyen finalmente otro elemento esencial en las prótesis contemporáneas.27-31
EXPERIENCIA CLÍNICA
Nuestra experiencia clínica con cotilos no cementados comienza en 1983 con la prótesis HG1 (Zimmer).14 En 1988 introducimos la prótesis HGII (Zimmer) muy similar en diseño, con un mecanismo captura del núcleo mejorado y con tornillos de mayor diámetro.11 Finalmente en 1993 comienza nuestra experiencia con el cotilo Trilogy (Zimmer), una prótesis de tercera generación que incorpora los conceptos de diseño contemporáneos mencionados anteriormente.32
La prótesis HGI ya no está en uso clínico pero su estudio representa una reseña histórica de mucho valor ya que nos permite identificar las causas de fracasos que ocurren a largo plazo. Recientemente re-evaluamos los resultados a largo plazo con la prótesis HGI en una serie consecutiva de 204 artroplastias primarias en 184 pacientes operados en nuestra institución.33 Estos pacientes fueron seguidos prospectivamente por un periodo de 20 a 24 años. Sesenta y nueve pacientes (75 caderas) habían fallecido, se perdieron cuatro pacientes (5 caderas) y quedaron en el estudio 124 caderas en 111 pacientes. Se trataba de un grupo de pacientes relativamente jóvenes con una edad promedio de cincuenta y dos años (20 a 84). Los diagnósticos incluyeron: osteoartritis en 122 pacientes (60%), necrosis avascular en 51 (25%), artritis reumatoide en 18 (9%), espondilitis anquilosante en 5(3%), artrosis post traumática en 4 (2%) y fractura del cuello femoral en 2 (1%).
La prótesis utilizada fue el cotilo HGI que consistía en una copa de Titanio C.P. revestido con fibra metálica de titanio. El núcleo de polietileno de ultra alto peso molecular estaba fabricado por torno y esterilizado por irradiación en aire.
La técnica quirúrgica utilizada en esta prótesis de primera generación no incluye impactar la prótesis ya que se usó una copa del mismo diámetro que la última fresa y la fijación inicial se obtuvo con un mínimo de tres tornillos.
Fueron necesarias 10 revisiones de cotilo con una frecuencia del 5%. En 8 de esas caderas las prótesis estaban fijas. Las causas fueron lisis retro cotiloidea en 4 caderas, infección peri protésica tardía en dos caderas, luxación recidivante en una y durante una revisión femoral en una cadera. En dos caderas (1%) la revisión fue necesaria por aflojamiento aséptico. De las 124 caderas seguidas por más de 20 años o hasta su revisión, 114 (92%) retuvieron la copa metálica original.
En 14 caderas adicionales con prótesis fijas (7%), fue necesario hacer un recambio del núcleo de polietileno por desgaste y/o osteolisis. Estas re-operaciones se hicieron a un promedio de 151 meses (79 a 253) después de la implantación original. El recambio del núcleo se ha indicado en 8 caderas adicionales. Vale decir que en 22 de los cotilos no revisados (20%) se ha hecho o se ha recomendado un recambio del núcleo.
Desde el punto de vista radiográfico 5 caderas (3%) estaban flojas a un mínimo de 20 años. En tres de estas caderas los pacientes no tienen síntomas y la revisión todavía no se ha indicado. La tasa de aflojamiento aumentó con el tiempo ya que en nuestro estudio previo del mismo grupo de pacientes a los 15 años12 solamente tres caderas estaban flojas.
Osteolisis, una complicación seria directamente relacionada con el desgaste del núcleo fue un fenómeno tardío presente en 42 caderas o el 20% del total. Se observó inicialmente a un promedio de 179 meses (42 a 254) después de la operación original. Ningún paciente que tenía más de 59 años cuando se hizo la operación original requirió re-operación por problema relacionado con el cotilo y ningún paciente con más de 65 años en ese mismo tiempo desarrolló osteolisis. Evidentemente, la edad del paciente tiene una influencia importante en la frecuencia de complicaciones relacionadas con el desgaste del polietileno.
Un riesgo más elevado de re-operación con respecto al cotilo estaba relacionado con núcleos de polietileno de menor espesor, pacientes de menor edad y cotilos en valgo o con mayor ángulo de inclinación, variables todas que afectan la tasa de desgaste del núcleo.12
Considerando el grupo total de 204 caderas, el análisis de supervivencia de Kaplan Meier34 utilizando revisión por aflojamiento o aflojamiento radiológico como definición de fracaso, indicó una supervivencia a los 20 años del 96% (94-98%). Utilizando reoperación por cualquier causa como definición de fracaso, la tasa de supervivencia fue 86% a los 20 años (83-89%). A los 20 años solo el 70% de las caderas (65-75%) no mostraron evidencia radiológica de osteolisis.
Nuestra experiencia con prótesis de tercera generación (Trilogy, Zimmer) que incorporan conceptos contemporáneos en su diseño comienza en 1993. Durante los primeros años, y en la experiencia inicial que se relata a continuación, se utilizó exclusivamente un núcleo de polietileno convencional esterilizado por irradiación en aire. Los núcleos de polietileno de alta reticulación y otros medios de esterilización son de introducción más reciente y su uso es de rutina corrientemente en nuestro centro.
La casuística inicial35 consiste en 193 caderas operadas en forma consecutiva en 176 pacientes con una edad promedio de 61 años (23-91). A un mínimo de 10 años (10 a 13), 132 pacientes (142 caderas) fueron evaluados en forma clínica y radiográfica. Treinta seis pacientes fallecieron y 6 todavía no han sido evaluados. Todas las prótesis se impactaron con 2 mm de diferencia entre el diámetro de la última fresa y la prótesis y en el 70% de los casos se utilizaron dos tornillos como fijación inicial adicional.
Fueron necesarias 5 revisiones (3.5%), 2 por luxación recidivante, 2 por infección y una prótesis revisada a los cuatro meses por aflojamiento. Hubo 8 recambios del núcleo, 5 (3.5%) de ellos por desgaste y osteolisis, 2 por luxación recidivante y 1 por tratamiento de una infección aguda hematógena. Osteolisis pericotiloidea se observó en 10 caderas (7%).
La tasa de supervivencia de Kaplan-Meier por aflojamiento fue 99.4% los 10 años (98.8-100%). Utilizando aflojamiento o revisión por cualquier causa la tasa de supervivencia fue 96% a los 10 años (94-98%).
ESTUDIOS EN NATERIAL DE AUTOPSIA
¿Qué ocurre a nivel de los tejidos que nos permita explicar estas observaciones y al mismo tiempo nos ayude a interpretar el mecanismo de fracaso a largo plazo?
Para abordar este tema realizamos un estudio de cotilos recuperados en autopsias junto con los tejidos vecinos.36 Se trata de un grupo 40 cotilos no cementados, HGI y HGII (Zimmer), recuperados en autopsia a un mínimo de 5 años después de su implantación. La edad promedio fue de 66 años (41-89) y los diagnósticos más frecuentes fueron osteoartritis y necrosis avascular.
La edad cuando los pacientes fallecieron fue 77 años (53-100), la duración 10 años (5-21) y la causa del deceso no estuvo relacionada con el reemplazo articular. Estos pacientes habían sido seguidos en forma prospectiva y tenían en general un resultado clínico excelente con un score de Harris promedio de 88 puntos (58-100).
Los métodos histológicos incluyen el estudio microscópico de secciones enteras del implante y tejidos vecinos sin descalcificar . El porcentaje de distintos tejidos en la interfas e y en el material poroso fue cuantificado (point counting) y las distintas partículas fueron identificadas por luz polarizada o con “energy dispersive x-ray analysis”. El daño en la cara convexa se cuantificó usando los cambios producidas en las marcas dejadas por proceso de fabricación por torneado ya que esa superficie estaba preservada frente a los orificios para tornillos.
Todas las prótesis estaban fijadas por crecimiento óseo con una distribución preferencial en la periferia de la copa y en la vecindad de los tornillos. El porcentaje de hueso en el material poroso fue de 35% (7 – 70). En algunas zonas el hueso tenía características densas ocupando todo el volumen de los poros. En otras el hueso estaba presente en forma de trabéculas delgadas (fig.1).
Figura 1: Corte para estudio histológico de implante y tejido sin descalcificar. Crecimiento óseo trabecular en la periferia de los tornillos, con algunas zonas de hueso denso ocupando el volumen de los poros de la superficie de integración. Granulomas en los orificios para tornillos y en la periferia de la copa con partículas de polietileno, productos de corrosión, titanio y aleación de titanio (Ti6Al4V).
En todos los casos se observaron granulomas en los orificios para tornillos y en la periferia de la copa. En los granulomas era evidente la presencia de partículas de polietileno, titanio y aleación de titanio (Ti6Al4V). En algunos casos se observaron también partículas de evidente origen femoral tal como cemento acrílico, cobalto-cromo, productos de corrosión o acero inoxidable.
El volumen de los granulomas en los orificios de la copa aumentó con el tiempo de implantación. En todos los casos can más de 7 años se observó una expansión del granuloma en el hueso periprostético con la penetración más profunda alrededor de los tornillos. En la periferia de la copa hubo menor penetración pero también progresó con el tiempo. Sin duda, los orificios con o sin tornillos constituyeron la vía de acceso preferencial para la progresión del granuloma en el hueso retrocotiloideo (Fig. 2).
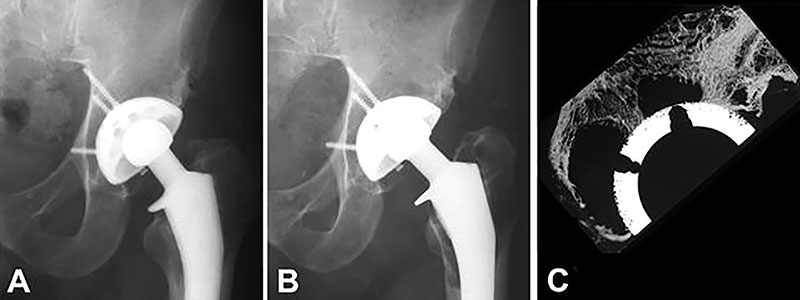
Figura 2: A) Radiografía 10 años post-implantación. B) 21 años post-implantación con cambios mínimos evidentes en la estructura del hueso pericotiloideo. C ) Granulomas masivos en la micro radiografía de contacto de una sección central del cotilo, recuperado en autopsia 21 años post-implantación.
Los granulomas pélvicos progresaron desde algunos milímetros entre 5 a 10 años, hasta lesiones masivas en varios casos de larga duración. Esto constituye un dilema clínico, ya que no se pueden visualizar en las radiografías de rutina .
Además de la progresión intrapélvica se observó invasión por granuloma de la interfaz y del revestimiento poroso. Esto representa una causa posible de aflojamiento a largo plazo, un fenómeno observado en la casuística relatada anteriormente después de los veinte años de implantación.
Los cambios observados en la cara convexa del núcleo fueron moderados, 7.7 puntos sobre 27 posibles, aumentaron con el tiempo y estaban correlacionados con la severidad del granuloma.
DISCUSIÓN
La reconstrucción del cotilo en reemplazo total de cadera primario con prótesis no cementada, hemisférica, modular, recubierta de fibra de titanio es en nuestro centro el procedimiento de elección. Requiere una técnica quirúrgica relativamente sencilla y rinde resultados clínicos excelentes y reproducibles.
Una conclusión evidente de nuestra experiencia clínica es que la fijación de la prótesis no es el problema a largo plazo. Actualmente el problema de fijación está resuelto. El desgaste de polietileno y sus consecuencias constituyen la causa más común de fracasos y es en el paciente joven donde se hacen evidentes. La edad refleja el nivel de actividad del paciente que influye los fenómenos mecánicos responsables por el aumento en la tasa de desgaste.
Los resultados obtenidos con el sistema de tercera generación son excelentes pero no fueron fundamentalmente distintos de los observados con la prótesis HG cuando se comparan con un tiempo de seguimiento similar.11,15 El polietileno utilizado en toda esta casuística no era el material contemporáneo de alta reticulación. Esto nos indica que el uso de materiales de alta resistencia al desgaste es la consideración más importante para evitar fracasos a largo plazo y que los otros cambios en el diseño de la prótesis aunque necesarios no son de por sí suficientes.
Nuestra experiencia en material de autopsia con prótesis de primera generación y polietileno de ultra alto peso molecular convencional confirma que la fijación por formación ósea ocurre en forma reproducible y persiste hasta después de la segunda década después de la implantación. Los mecanismos de fracaso son producto del desgaste y la subsecuente formación de granuloma. El fracaso puede ocurrir como resultado de osteolisis pélvica masiva y después de la segunda década también por aflojamiento tardío secundario a la infiltración por granuloma de la interfaz y del revestimiento poroso.
La cara convexa del núcleo representó una fuente de partículas en las prótesis de primera generación con un rol importante en la patogénesis del granuloma. Sin embargo, la modularidad es un requisito imprescindible desde nuestro punto de vista. Las soluciones posibles que forman parte de los diseños contemporáneos incluyen: impactar sin tornillos, prótesis sin orificios, un mecanismo de captura adecuado, congruencia entre el núcleo y la copa, superficie lisa o pulida en la cara cóncava de la copa metálica pero sobre todo el uso de un material resistente al desgaste.
La osteolisis no se acompaña de síntomas clínicos hasta alcanzar una evolución avanzada. Por eso el control radiográfico periódico después de los diez años de la cirugía original es esencial para prevenir consecuencias que pueden ser desastrosas cuando ocurre una pérdida masiva del hueso pélvico. Las radiografías de rutina no muestran la magnitud real de las lesiones. Desde un punto de vista práctico, en presencia de desgaste severo con o sin osteolisis, la tomografía computarizada puede dar información adicional de mucho valor clínico.37
La intervención temprana es preferible en pacientes activos sin síntomas pero con evidencia de desgaste progresivo severo con o sin osteolisis pélvica. En presencia de una copa fija, con buena orientación y con stock óseo adecuado, el recambio del núcleo representa una alternativa deseable a una revisión completa del cotilo.38 - 40 Nosotros preferimos cementar dentro de la copa un núcleo de polietileno de alta reticulación y utilizamos una cabeza femoral de 32 mm de diámetro. Debemos recordar que todavía existe un número importante de pacientes que están en riesgo ya que la introducción de las nuevas superficies articulares es relativamente reciente.
El uso de estos materiales en combinación con cotilos de diseño moderno disminuirá en forma dramática la posibilidad de fracasos a largo plazo inducidos por granuloma. Las excepciones posibles para su uso incluyen los pacientes de mayor edad (> de 70 años) o aquellos con incapacidades serias que solo permiten un nivel de actividad limitado.
Una discusión detallada de los méritos relativos de cada uno de estos materiales no es posible dentro de los límites de este artículo. En nuestro centro se utiliza casi en forma exclusiva el polietileno de alta reticulación en el cotilo con una cabeza femoral de cobalto-cromo como la articulación de preferencia en reemplazo total de cadera. Sin embargo, la experiencia clínica con todos estos materiales, polietileno de alta reticulación y articulaciones metal-metal o cerámica- cerámica, es relativamente corta y no sin problemas potencialmente serios.41-50 Por lo tanto el estudio de estos pacientes a largo plazo es imprescindible para evitar en el futuro la posibilidad de complicaciones importantes e inesperadas.
BIBLIOGRAFÍA
- Galante JO. Bone Ingrowth in Porous Materials. In Lewis JL and Galante JO (ed.), The Bone-Implant Interface: Workshop Report, Am Academy Orthop Surg, Chicago, IL; 1985:172-183.
- Galante JO, Rostoker W, Lueck R, Ray RD. Sintered fiber composites as a basis for attachment of implants to bone. J Bone Joint Surg. 1971; 53(A):101-114.
- Andersson GBJ, Gaechter A, Galante JO, Rostoker W. Segmental replacement of long bones in baboons using a fiber titanium implant. J. Bone Joint Surg Am. 1978;60:31-40, 1978.
- Galante JO, Rostoker W. Fiber metal composites in the fixation of skeletal prosthesis. J Biomed Mat Res. 1973; 4:43-61.
- Kuo KN, Gitelis S, Sim FH, Pritchard D, Chao E, Rostoker W, Galante JO, McDonald P. Segmental replacement of long bones using titanium fiber metal composite following tumor resection. Clin Orthop Rel Res. 1983; 176:108-114.
- Pidhorz LE, Urban RM, Jacobs JJ, Sumner DR, Galante JO. A quantitative study of bone and soft tissues in cementless porous coated acetabular components retrieved at autopsy. J Arthroplasty. 1993; 8:213-225.
- Rivero DP, Fox J, Skipor AK, Urban RM, Galante JO. Calcium phosphate-coated porous titanium implants for enhanced skeletal fixation. J Biomed Mat Res. 1988; 22:191-201.
- Ronningen H, Lereim P, Galante JO, Rostoker W, Turner T, Urban R. Total surface hip arthroplasty in dogs using a fiber metal composite as a fixation method. J Biomed Mat Res. 1983; 17:643-653.
- Turner TM, Sumner DR, Urban RM, Rivero DP, Galante JO. A comparative study of porous coatings in a weight-bearing total hip-arthroplasty model. J Bone Joint Surg Am. 1986; 68:1396-1409.
- Woodman JL, Jacobs JJ, Galante JO, Urban RM. Metal ion release from titanium-based prosthetic segmental replacements of long bones in baboons: a long term study. J Orthop Res. 1984; 1:421-430.
- Archibeck MJ, Berger RA, Jacobs JJ, Quigley LR, Gitelis S, Rosenberg AG, Galante JO. Second-generation cementless total hip arthroplasty. Eight to eleven-year results. J Bone Joint Surg Am. 2001; 83:1666-73.
- Della Valle CJ, Berger RA, Shott S, Rosenberg AG, Jacobs JJ, Quigley L, Galante JO. Primary total hip arthroplasty with a porous-coated acetabular component. A concise follow-up of a previous report. J Bone Joint Surg Am, 2004; 86: 1217-22.
- Gaffey JL, Callaghan JJ, Pedersen DR, Goetz DD, Sullivan PM, Johnston RC. Cementless acetabular fixation at fifteen years. A comparison with the same surgeon's results following acetabular fixation with cement. J Bone Joint Surg Am. 2004; 86(2):257-61.
- Martell, J, Pierson RH3rd, Jacobs JJ, Rosenberg AG, Maley M, Galante JO. Primary total hip reconstruction with a titanium fiber-coated prosthesis inserted without cement. J Bone Joint Surg Am. 1993; 75A: 554-71.
- Tompkins GS, Jacobs JJ, Kull LR, Rosenberg AG, Galante JO. Primary total hip arthroplasty with a porous-coated acetabular component. Seven-to-ten-year results. J Bone Joint Surg Am. 1997; 79:169-76.
- Macheras G, Kateros K, Kostakos A, Koutsostathis S, Danomaras D, Papagelopoulos PJ. Eight to ten year clinical and radiographic outcome of a porous tantalum monoblock acetabular component. J Arthroplasty. 2008 Aug 12. [Epub ahead of print].
- Ihle M, Mai S, Pfluger D, Siebert W. The results of the titanium-coated RM acetabular component at 20 years: a long term follow up of an uncemented primary total hip replacement. J Bone Joint Surg Br. 2008; 90:1284-90.
- Belmont PJ Jr, Powers CC, Beykirch SE, Hopper RH Jr, Engh CA Jr, Engh CA. Results of the anatomic medullary locking total hip arthroplasty at a minimum of twenty years. A concise follow-up of previous reports. J Bone Joint Surg Am. 2008; 90:1524-30.
- Kawamura H, Dunbar MJ, Murray P, Bourne RB, Rorabeck CH. The porous coated anatomic total hip replacement. A ten to fourteen-year follow-up study of a cementless total hip arthroplasty. J Bone Joint Surg Am. 2001; 83(9):1333-8.
- Capello WN, D'Antonio JA, Feinberg JR, Manley MT. Ten-year results with hydroxyapatite-coated total hip femoral components in patients less than fifty years old. A concise follow-up of a previous report. J Bone Joint Surg Am. 2003; 85(5):885-9.
- Manley MT, Capello WN, D'Antonio JA, Edidin AA, Geesink RGT. Fixation of acetabular cups without cement in total hip arthroplasty. A comparison of three different implant surfaces at a minimum duration of follow-up of five years. J Bone Joint Surg Am. 1998; 80:1175-85.
- Haidukewych G, Jacofsky DJ, Hanssen AD, Lewallen DG. Intraoperative fractures of the acetabulum during primary total hip arthroplasty. J Bone Joint Surg Am. 2006; 88:1952-56.
- Bruijn JD, Seelen JL, Feenstra RM, Hansen BE, Bernoski FP. Failure of the Mecring screw-ring acetabular component in total hip arthroplasty. A three to seven-year follow-up study. J Bone Joint Surg Am. 1995; 77:760-66.
- Grübl A, Chiari C, Giurea A, Gruber M, Kaider A, Marker M, Zehetgruber H, Gottsauner-Wolf F. Cementless total hip arthroplasty with the rectangular titanium Zweymüller stem. A concise follow-up, at a minimum of fifteen years, of a previous report. J Bone Joint Surg Am. 2006; 88:2210-15.
- Udomkiat P, Dorr LD, Wan Z. Cementless hemispheric porous-coated sockets implanted with press-fit technique without screws: average ten-year follow-up. J Bone Joint Surg Am.2002; 84:1195-200.
- Archibeck MJ, Cummins T, Junick DW, White RE Jr. Acetabular loosening using an extended offset polyethylene liner. Clin Orthop Rel Res. 2009; 467(1):188-93.
- Heisel C, Silva M, Schmalzried TP. Bearing surface options for total hip replacement in young patients. J Bone Joint Surg Am. 2003; 85:1366-79.
- Jacobs JJ, Urban RM, Hallab NJ, Skipor AK, Fischer A, Wimmer M. Metal on metal bearing surfaces. J Amer Acad Orthop Surg (In Press)
- Jacobs CA, Christensen CP, Greenwald AS, McKellop H. Clinical performance of highly cross-linked polyethylenes in total hip arthroplasty. J Bone Joint Surg Am. 2007; 89:2779-86,
- Huo MH, Parvizi J, Bal SB, Mont MA. What's new in total hip. J Bone Joint Surg Am. 2008; 90:2043-55.
- Lusty PJ, Tai CC, Sew-Hoy RP, Walter WL, Walter WK, Zicat BA. Third generation alumina-on-alumina ceramic bearings in cementless total hip arthroplasty. J Bone Joint Surg Am. 2007; 89:2676-83.
- Valle AG, Zoppi A, Peterson MG, Salvati EA. Clinical and radiographic results associated with a modern, cementless modular cup design in total hip arthroplasty. J Bone Joint Surg Am. 2004; 86(9):1998-2003.
- Della Valle CJ, Mesko NW, Quigley L, Rosenberg AG, Jacobs JJ, Galante JO. Primary total hip arthroplasty with a porous coated acetabular component: A follow-up note at a minimum of twenty years in the concise format. J Bone Joint Surg, in press.
- Kaplan EL. Nonparametric estimation from incomplete observations. J Am Stat Assoc. 1958; 53: 457-481.
- Amenábar P, Della Valle CJ, Royce B, Quigley L, Berger RA, Rosenberg AG, Galante JO. Third generation cementless acetabular components: Clinical and radiographic results at a minimum of 10 years. In Proceed Amer Acad Orthop Surgeons 2008 Annual Meeting, San Francisco, CA, p. 431.
- Urban RM, Hall DJ, Jacobs JJ, Pourzal R, Wimmer MA, Sumner DR, Galante JO. Long-term fixation and potential failure mechanisms in cementless acetabular components retrieved postmortem. Trans Orthop Res Soc. 2007; 32:1716.
- Howie DW, Neale SD, Stamenkov R, McGee MA, Taylor DJ, Findlay DM. Progression of acetabular periprosthetic osteolytic lesions measured with computed tomography. J Bone Joint Surg Am. 2007; 89:1818-25.
- Beaulé Pl , Ebramzadeh E, LeDuff M, Prasad R, Amstutz HC. Cementing a liner into a stable cementless acetabular shell: The double-socket technique. J Bone Joint Surg Am. 2004; 86:929 34.
- Bonner KF, Delanois RE, Harbach G, Bushelow M, Mont MA. Cementation of a polyethylene liner into a metal shell. Factors related to mechanical stability. J Bone Joint Surg Am. 2002; 84:1587-93.
- Haft GF, Heiner AD, Dorr LD, Brown TD, Callaghan JJ. A biomechanical analysis of polyethylene liner cementation into a fixed metal acetabular shell. J Bone Joint Surg Am. 2003; 85:1100-10.
- Davies AP, Willert HG, Campbell PA, Learmouth ID, Case CP. An unusual lymphocytic perivascular infiltration in tissues around contemporary metal-on-metal joint replacements. J Bone Joint Surg Am. 2005; 87:18-27.
- Dunstan E, Ladon D, Whittingham-Jones P, Carrington R, Briggs TWR. Chromosomal aberrations in the peripheral blood of patients with metal-on-metal hip bearings. J Bone Joint Surg Am. 2008; 90:517-22
- Hallab NJ, Anderson S, Caicedo M, Skipor AK, Campbell P, Jacobs JJ. Immune responses correlate with serum-metal in metal-on-metal hip arthroplasty. J Arthroplasty. 2004; 19(3): 88-93.
- Jacobs JJ, Hallab NJ. Loosening and osteolysis associated with metal-on-metal bearings: A local effect of metal hypersensitivity? J Bone Joint Surg Am. 2006; 88:1171-72.
- Korovessis P, Petsinis G, Repanti M, Repantis T. Metallosis after contemporary metal-on-metal total hip arthroplasty. Five to nine year follow-up. J Bone Joint Surg Am. 2006; 88:1183-91.
- Koo KH, Ha YC, Jung WH, Kim SR, Yoo JJ, Kim HJ. Isolated fracture of the ceramic head after third-generation alumina-on-alumina total hip arthroplasty. J Bone Joint Surg Am. 2008; 90:329-36.
- Park Y-S, Moon Y-W, Lim S-J, Yang J-M, Ahn G, Choi Y-L. Early osteolysis following second-generation metal-on-metal hip replacement. J Bone Joint Surg Am. 2005; 87:1515-21.
- Poggie RA., Turgeon TR, Coutts RD. Failure analysis of a ceramic bearing acetabular component. J Bone Joint Surg Am. 2007; 89:367-75.
- Tower SS, Currier JH, Currier BH, Lyford KA, Van Citters DW, Mayor MB. Rim cracking of the cross-linked longevity polyethylene acetabular liner after total hip arthroplasty. J Bone Joint Surg Am. 2007; 89:2212-17.
- Willert HG, Buchhorn GH, Fayyazi A, Flury R, Windler M, Koster G, Lohmann CH. Metal-on-metal bearings and hypersensitivity in patients with artificial hip joints. A clinical and histomorphological study. J Bone Joint Surg Am. 2005; 87:28-36.