REV. ACARO | 2017: Vol. 3, N°2: 61-67
Alta seguridad y eficacia del ácido tranexámico en prótesis total de cadera primaria
Dr. Alejandro Fígar, Dr. Santiago McLoughlin, Dr. Pablo Slullitel, Dr. Walter Scordo, Dr. Gerardo Zanotti, Dr. Fernando Comba, Dr. Martín Buttaro, Dr. Francisco Piccaluga.
Hospital Italiano de Buenos Aires
Correspondencia:
Dr. Pablo Slullitel
pablo.slullitel@hiba.org.ar
Los autores declaran NO tener conflictos de interés
RESUMEN
Introducción: Varios reportes han probado la eficacia y seguridad del ácido tranexámico (TXA) en reducir la pérdida sanguínea en prótesis total de cadera (PTC). Sin embargo, muchos de estos estudios han analizado la acción del TXA con dosificaciones variadas, distintos tiempos de administración y diversos tipos de anestesia. Por ello, la estrategia de dosificación del TXA más eficaz aún resulta controversial. Nuestro objetivo fue estudiar los efectos de una dosis única de 1gr preoperatorio de TXA, administrada como bolo intravenoso, en la tasa de transfusión de pacientes sometidos a PTC .
Material y métodos: Efectuamos un estudio retrospectivo, entre enero 2012 y enero 2014, de 172 pacientes consecutivos sometidos a PTC primaria electiva. Se excluyeron pacientes con discrasias sanguíneas, tratamiento antitrombótico, historia de insuficiencia hepática o renal, epilepsia y enfermedad tromboembólica (ETE). Dividimos a la serie en el grupo que recibió TXA y en control . Evaluamos el número de transfusiones de glóbulos rojos (TGR) y las complicaciones .
Resultados: El uso del TXA presentó una correlación significativa con la TGR (p<0.0001 CI 95%: -1.24 and –0.68). . Seis pacientes del grupo control fueron reinternados (2 infecciones profundas) mientras que 3 lo hicieron en el grupo TXA (0 infecciones), sin hallarse diferencias entre ambos (p=N/A). No se diagnosticaron pacientes fallecidos durante el seguimiento.
Conclusiones: Una dosis única preoperatoria de TXA redujo la tasa de TGR sin aumentar la incidencia de efectos adversos, .
Nivel de Evidencia: 3
Palabras Clave: Reemplazo Total de Cadera Primario; Ácido Tranexámico; Anemia Perioperatoria
ABSTRACT
Introduction: To determine the effects of tranexamic acid (TXA) on transfusions in patients undergoing hip replacement with a hybrid or cementless prosthesis.
Methods: A group of 172 consecutive patients aged 18 years or older who underwent elective hip replacement with uncemented or hybrid prostheses, undergoing surgery between January 2012 and January 2014 by the same primary surgeon and anesthesiologist, were retrospectively included. TXA (1g) was administered immediately before incision in the TXA group. Primary variables included number of red blood cell transfusions and the influence of TXA for each type of prosthesis. Secondary variables included hematocrit at discharge, length of hospital stay, thrombosis or pulmonary embolism, seizures, and death.
Results: TXA use was significantly correlated with the number of units transfused (p < 0.0001, 95% CI -1.24 to -0.68). No difference was observed between the groups regarding adverse effects. Hematocrit values at discharge and length of hospital stay were similar between groups. No deaths were observed during hospital stay.
Conclusions: TXA reduced transfusions without increasing the prevalence of adverse effects.
Level of Evidence: 3
Key Words: Primary Total Hip Replacement; Tranexamic Acid; Perioperative anemia
INTRODUCCIÓN
La cirugía de prótesis total de cadera (PTC) está indudablemente asociada a una pérdida sustancial de sangre y a altas tasas de transfusión de glóbulos rojos (TGR). Numerosas estrategias han sido empleadas para intentar disminuir la necesidad de transfusiones postoperatorias, incluyendo transfusiones intraoperatorias de sangre autóloga, anestesia espinal, anestesia hipotensora, ahorro intraoperatorio de sangre y terapias antifibrinolíticas.1
Un gran número de reportes han probado la eficacia y seguridad del ácido tranexámico (TXA) en reducir la pérdida sanguínea en pacientes sometidos a prótesis total de cadera (PTC) y prótesis total de rodilla (PTR) primarias.2,3 Sin embargo, muchos de estos estudios han analizado la acción del TXA sin discriminar su efecto particular en reemplazos de cadera o rodilla individualmente.3-5 A su vez, en la bibliografía se han descripto dosificaciones variadas de TXA, distintos tiempos de administración y diversos tipos de anestesia, incluso sin discriminar entre los distintos tipos de PTC (híbrida, cementada, no cementada). Dichas variables podrían considerarse confundidoras a la hora de analizar los resultados postoperatorios de eficacia y complicaciones.
Por ello, la estrategia de dosificación del TXA más eficaz aún resulta controversial según las guías ortopédicas.5-7 De esta manera, nuestro objetivo fue estudiar los efectos de una dosis única de 1gr preoperatorio de TXA, administrada como bolo intravenoso, en la tasa de transfusión, estadía hospitalaria y readmisión en pacientes sometidos a PTC electiva ejecutada por un mismo cirujano, utilizando anestesia espinal efectuada por el mismo anestesiólogo.
MATERIAL Y MÉTODOS
Selección de los pacientes
Luego de obtener la aprobación del Comité de Ética de nuestra institución, hemos estudiado retrospectivamente a un grupo de 172 pacientes consecutivos, mayores de 18 años, tratados con una PTC primaria electiva entre, Enero 2012 y Enero 2014. Se incluyeron sólo pacientes operados por el mismo cirujano y mismo anestesiólogo. Aquellos pacientes operados por el cirujano principal pero anestesiados por un distinto anestesiólogo, fueron excluidos. Asimismo, se excluyeron pacientes con discrasias sanguíneas, tratamiento antitrombótico, historia de insuficiencia hepática o renal, epilepsia y enfermedad tromboembólica (ETE); dado que el protocolo estandarizado por el Servicio de Hematología de nuestra institución considera a éstos pacientes como no adecuados para recibir terapia con TXA profiláctica.
Durante el periodo analizado, 172 pacientes fueron sometidos a una PTC primaria cumpliendo con los criterios de selección establecidos. El tiempo promedio de duración quirúrgica fue 59 minutos (rango, 30-82). Ochenta y cinco pacientes (49%) recibieron una bolo único de TXA inmediatamente antes de la incisión. Las características demográficas de los pacientes y características de la cirugía fueron similares entre ambos grupos (Tabla 1).
Tabla 1: Características demográficas de la serie.
Todos los pacientes fueron operados mediante la misma técnica quirúrgica, a través de un abordaje posterolateral de cadera mínimamente invasivo en posición decúbito lateral. En casos de utilizarse implantes híbridos con vástagos cementados, fue utilizada una técnica de cementado de tercera generación con la aplicación de una dosis endovenosa profiláctica de heparina de bajo peso molecular durante la inserción del vástago. En todos los casos, se utilizó una anestesia espinal con hidroclorato de bupivacaína hiperbárica (10 a 15mg) más fentanilo (25 mcg) y sedación con propofol continuo. Se aplicó una dosis profiláctica de 2 gramos endovenosos de cefazolina inmediatamente antes de la cirugía, seguidos por 1 gramo cada 8 horas durante las siguientes 24 horas. La información demográfica y quirúrgica de los pacientes fue recolectada de la base de datos digital registrada en historia clínica electrónica de nuestra institución, de recolección prospectiva. La utilización de TXA y el tiempo de estadía hospitalaria se obtuvieron de los registros de facturación institucionales.
Grupos de estudio y variables
Hemos dividido a nuestra serie en 2 grupos. Los 85 pacientes que recibieron una dosis única de 1 gr de TXA inmediatamente antes de la incisión fueron incluidos en el grupo TXA, mientras que el grupo remanente se consideró el control. Adicionalmente, clasificamos a las PTC como híbridas o no cementadas en función de la fijación femoral. Las características demográficas estudiadas de los pacientes fueron edad, sexo, peso, score prequirúrgico de ASA (American Society of Anesthesiologists), duración de la cirugía y hematocrito previo (Ht). Las variables primarias fueron el número de TGR (sea autóloga o alogénica ), el riesgo relativo para transfusión en general así como el riesgo relativo específico para transfusiones de más de una unidad de glóbulos rojos. Dado que los protocolos de transfusión difirieron ligeramente entre los elegidos por el anestesiólogo y los utilizados en la sala de internación general, hemos estudiado en forma aislada a aquellas TGR realizadas intraoperatoriamente de aquellas efectuadas en la sala general durante el resto de la estadía hospitalaria. Hemos efectuado un sub-análisis para identificar la influencia del TXA entre los distintos tipos de PTC (híbridas o no cementadas). Las variables secundarias involucraron: hematocrito de alta, tiempo de estadía hospitalaria, enfermedad tromboembólica, convulsiones, readmisiones dentro de los 3 meses postoperatorios y mortalidad. Las readmisiones fueron definidas como nuevas hospitalizaciones dentro de un periodo de 90 días luego del alta, relacionadas o no con un problema inadecuadamente resuelto durante la hospitalización previa.8
Protocolos de transfusión
Los pacientes fueron transfundidos utilizando 2 protocolos distintos durante su estadía hospitalaria. El protocolo utilizado por el anestesiólogo durante la cirugía y el periodo inmediato en la sala de recuperación de anestesia incluyó el siguiente criterio: 1) si la hemoglobina fuere 8g/dl o menos ; 2) si la hemoglobina fuere 10g/dl o menos en pacientes cardiovasculares (historia de isquemia miocárdica, evidencia electrocardiográfica de isquemia previa, historia o presencia de insuficiencia cardiaca congestiva o enfermedad vascular periférica, o historia o presencia de accidente cerebrovascular) ; 3) si hubiere hipotensión o taquicardia no respondedora a resucitación con fluidos, o evidencia clínica de sangrado mayor activo. Por otro lado, el protocolo utilizado por el Servicio de Hematología durante el resto de la estadía hospitalaria de los pacientes consistió en el siguiente: 1) si la hemoglobina fuere 7g/dl o menos, 2) si el hematocrito fuere 20% o menor, 3) si la hemoglobina fuere 10g/dl o menos en pacientes cardiovasculares.
Análisis estadístico
Las variables continuas se expresaron como mediana y rango inter-cuartil. El test de Mann-Whitney U se utilizó para analizar las variables continuas. El test exacto de Fisher se usó como prueba de significancia estadística para las variables categóricas. Se efectuó un análisis de regresión múltiple seleccionando el número de unidades de glóbulos rojos como la variable independiente, comparándola con la edad, el peso, el Ht previo, la duración de la cirugía y la administración de TXA. El riesgo relativo (OR) se presentó con intervalos de confianza de 95%. Un valor de p<0.05 se consideró como estadísticamente significativo. El análisis estadístico fue ejecutado utilizando el programa R (versión 2.7.0).
RESULTADOS
Un total de 184 unidades de glóbulos rojos fueron transfundidas entre ambos grupos ( fig. 1). La TGR promedio fue de 1.53 unidades/paciente en el grupo control y 0.6 unidades/paciente en el grupo TXA (z= 6.29; U= 1640.5 p<0.0001). Ninguno de los pacientes fue transfundido antes de la cirugía. Según el análisis de regresión múltiple, el número de TGR no evidenció una correlación significativa con la edad, el ASA, el peso, el tipo de prótesis, la duración de la cirugía o el Ht previo. El uso aislado del TXA presentó una correlación significativa con la TGR (p<0.0001 CI 95%: -1.24 and –0.68).
Figura 1: Transfusiones en el grupo tranexámico (TXA) y en el grupo control. RBC: glóbulos rojos.
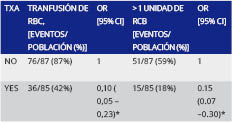
La transfusión de al menos 1 unidad alogénica de glóbulos rojos sucedió en 36 pacientes en el grupo TXA y en 76 del grupo control. Un 89,4% (OR: 0.106; CI 0.05-0.23; p< 0.0001) de reducción de riesgo relativo para transfundir al menos 1 unidad de eritrocitos fue observada en el grupo TXA. El mismo riesgo de reducción persistió cuando la transfusión fue de más de 1 unidad (Tabla 2).
Tabla 2: Resultados de la transfusión de eritrocitos. OR [95% CI] = Riesgo relativo para transfusión de glóbulos rojos y para mas de una unidad de glóbulos rojos, expresada con un intervalo de confianza de 95%. RBC= glóbulos rojos. * = P<0,001
Un 42% de los pacientes del grupo TXA y un 83% del grupo control fueron transfundidos durante la cirugía o en la sala de recuperación anestésica. Durante el resto de la estadía hospitalaria, sólo 1 paciente del grupo TXA (1.1%) y 8 (9.2%) del grupo control fueron transfundidos. Así, el riesgo relativo de reducción de la TGR se observó tanto durante la cirugía (OR: 0.14; CI 0.06-0.29; p<0.0001) como en el resto de la estadía hospitalaria (OR: 0.11; CI 0.01-0.96; p=0.046).
Con respecto a la TGR en función del tipo de prótesis, no existieron diferencias en la TGR entre prótesis híbridas y no cementadas tanto durante la cirugía como durante el resto de la hospitalización (p=0.13 y p=0.3) independientemente del uso de TXA ( fig. 2). Sin embargo, hemos observado que ambos tipos de prótesis que recibieron TXA profiláctico disminuyeron significativamente el número de TGR en comparación con las que no recibieron TXA (0.57 ± 1 vs. 1.7 ± 1 p <0.01 and 0.65 ± 1 vs. 1.24 ± 1 p<0.01).
No se observaron diferencias significativas entre ambos grupos con respecto al desarrollo de trombosis venosa profunda, embolia pulmonar o convulsiones. Sólo un paciente de la serie, perteneciente al grupo TXA, presentó una convulsión que requirió tratamiento médico. Seis pacientes (6.9%) del grupo control fueron reinternados durante los 90 días post-alta, como se describe en la Tabla 3. Dos de ellos fueron diagnosticados con una infección profunda de la herida que requirió desbridamiento quirúrgico y antibioticoterapia endovenosa. Por otro lado, 3 pacientes (3.5%) del grupo TXA fueron readmitidos al hospital; ninguno de ellos con una infección del sitio quirúrgico. El valor del hematocrito al alta y el tiempo de estadía hospitalaria fue similar entre ambos grupos. No se reportaron fallecimientos durante el seguimiento (Tabla 4).
Figura 2: Transfusiones en el grupo tranexámico (TXA) y en el grupo control para prótesis total de cadera hibridas y no cementadas. RBC: glóbulos rojos
Tabla 3: Readmisión de pacientes en función del uso de ácido tranexámico. Ns: No significativo.
Tabla 4: Resultados postoperatorios evidenciando complicaciones, efectos adversos y mortalidad en función del uso de ácido tranexámico
DISCUSIÓN
De acuerdo con nuestros resultados, una dosis única endovenosa de 1 gr de TXA administrado inmediatamente antes de la incisión ha logrado disminuir considerablemente la necesidad de transfundir eritrocitos en pacientes sometidos a PTC primaria bajo anestesia espinal. Esta reducción fue efectiva y segura tanto para las prótesis híbridas como para las no cementadas; y su beneficio no sólo fue valorado intraoperatoriamente sino que también lo fue durante toda la estadía hospitalaria.
Numerosos estudios han probado el efecto benéfico del TXA sobre las transfusiones en pacientes sometidos a PTC,9-10 incluso en pacientes con anemia preoperatoria.11 Empero, yace implícito el sesgo de utilizar distintos tipos de implantes (cementados o no) y diferentes tipos de anestesia, que pueden actuar como confundidores. Tradicionalmente, las prótesis totales de cadera cementadas o híbridas se han asociado a un mayor sangrado quirúrgico que las no cementadas, debido en gran parte al mayor tiempo quirúrgico que demandan las primeras.12,13
Sin embargo, esta premisa no está universalmente aceptada. Al comparar entre implantes híbridos , cementados y no cementados, un estudio retrospectivo efectuado por Trice y cols.14 no evidenció diferencias en requerimientos de sangre. Adicionalmente, en un estudio que originalmente se diseñó para comparar 2 drogas trombo profilácticas en el cual el TXA fue administrado de acuerdo a la preferencia del cirujano principal, Rajesparan y cols.15 encontraron que el TXA fue efectivo en reducir las TGRs en pacientes que recibieron prótesis híbridas , cementadas y no cementadas, disponiendo de distintas técnicas anestésicas. Más recientemente, un estudio prospectivo, randomizado ha concluido que combinar TXA en forma local y sistémica en PTC primaria no cementada, logró aumentar los niveles postoperatorios de hemoglobina y reducir la pérdida total de sangre al compararlo con la administración aislada de TXA endovenoso.16 En nuestro estudio de 172 pacientes, no existió diferencia en cuanto a TGR en el ratio de transfusiones entre PTC híbridas y no cementadas; y el TXA disminuyó la pérdida sanguínea en forma significativa para ambos implantes. A diferencia de estudios previos, el cirujano principal y el anestesiólogo principal fueron los mismos en cada una de las cirugías, utilizando anestesia espinal en todos los casos. Creemos que nuestros resultados refuerzan la seguridad y eficacia del TXA en PTC primaria, así como contribuyen a elucidar la influencia no claramente establecida del TXA en los diferentes tipos de prótesis comúnmente utilizadas.
La vida media de 1000 mg de TXA administrados por vía endovenosa es de aproximadamente 1.9 horas17 y su concentración en el plasma sanguíneo se mantiene por encima del valor mínimo terapéutico por aproximadamente 3 horas luego de una dosis de 10 mg/kg.18,19 Estos hallazgos son consistentes con previas observaciones que demostraron reducciones significativas de pérdida sanguínea durante incluso 4 horas.20 En acuerdo con esto, las transfusiones durante la cirugía y el resto de la hospitalización fueron reducidas en nuestra serie, considerando una duración promedio de la cirugía de 59 minutos. Nuestra observación de una disminución en la tasa de TGR durante el resto de los días postoperatorios (cuando el nivel plasmático de TXA se encontraría por debajo del terapéutico) podría interpretarse como un efecto beneficioso de una estrategia de hemostasia inicial.
A pesar de que el TXA es un inhibidor de la fibrinólisis que no afecta inicialmente la formación de coágulos, existe una preocupación teórica de su asociación potencial con el desarrollo de eventos tromboembólicos.21,22 Investigaciones previas han reportado una ausencia de riesgo aumentado de enfermedad tromboembólica inclusive en pacientes con antecedentes de embolia pulmonar.23-26 En nuestra serie, no existieron diferencias significativas ni relevantes entre ambos grupos en cuanto a tromboembolismos pulmonares.
Las convulsiones se han asociado asimismo con el uso del TXA en diversos estudios clínicos, especialmente luego de cirugía cardiaca, pacientes añosos y aquéllos con función renal alterada.27,28 Estudios en animales han sugerido que existe una reducción de receptores GABAA mediada por vía postsináptica en forma inhibitoria por el TXA, y ello podría promover una actividad epileptiforme en el sistema nervioso central.29 En nuestro conocimiento, ningún estudio ha analizado este efecto adverso en particular en una población sometida a PTC primaria en el contexto de TXA profiláctico. Nuestros resultados evidenciaron sólo 1 paciente del grupo TXA con convulsiones durante el postoperatorio. A pesar de no ser un dato significativo, este hallazgo incita a considerar este potencial efecto adverso a la hora de indicar TXA a pacientes de riesgo en PTC s electivas.
A pesar de existir una tendencia hacia mayor número de readmisiones debido a infecciones profundas del sitio quirúrgico en el grupo control, nuestros valores no fueron estadísticamente significativos para identificar una asociación entre no usar TXA y futuras re-hospitalizaciones. Estudios previos han asociado significativamente la presencia de hematoma postoperatoria y el drenaje prolongado de la herida, con el desarrollo de infecciones en pacientes con PTC.30,31 Una revisión sistemática de la literatura, luego de evaluar los factores de riesgo para infección luego de hemiartroplastias, ha concluido que el tiempo de estadía hospitalaria, la presencia de hematoma, el drenaje prolongado de la herida, el tiempo quirúrgico aumentado, el uso de vástagos no cementados, la edad avanzada y la obesidad fueron todos factores de riesgo independientes que contribuyeron a infección profunda. Al igual que los autores, nosotros también consideramos al hematoma como un factor de riesgo mayor para desarrollar infecciones; y con el advenimiento del TXA, una disminución de esta complicación podría anticiparse. No obstante, se precisa de estudios prospectivos que validen el uso del TXA como un factor protector independiente de infecciones en PTC.
Los hallazgos de este estudio están limitados por la naturaleza retrospectiva del mismo. Sin embargo, 172 pacientes consecutivos fueron incluidos y sometidos a PTC bajo una técnica estandarizada realizada por el mismo cirujano y el mismo anestesiólogo. En conclusión, una dosis única preoperatoria de TXA redujo la tasa de TGR sin aumentar la incidencia de efectos adversos, estadía hospitalaria, readmisiones hospitalarias ni mortalidad, tanto para prótesis híbridas como no cementadas.
BIBLIOGRAFÍA
- Taylor SE, Cross MH. Clinical strategies to avoid blood transfusion. Anaesth Intensive Care Med [Internet]. Elsevier Ltd; 2013;14(2):48–50. Available from: http://dx.doi.org/10.1016/j.mpaic.2012.11.012
- Barrachina B, Lopez-Picado A, Remon M, Fondarella A, Iriarte I, Bastida R, et al. Tranexamic Acid Compared with Placebo for Reducing Total Blood Loss in Hip Replacement Surgery. Anesth Analg [Internet]. 2016;122(4):986–95. Available from: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00000539-201604000-00009
- Poeran J, Rasul R, Suzuki S, Danninger T, Mazumdar M, Opperer M, et al. Tranexamic acid use and postoperative outcomes in patients undergoing total hip or knee arthroplasty in the United States: retrospective analysis of effectiveness and safety. BMJ [Internet]. 2014;349(August):g4829. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=4130961&tool=pmcentrez&rendertype=abstract
- Hogan CA, Golightly LK, Phong S, Dayton MR, Lyda C, Barber GR. Perioperative blood loss in total hip and knee arthroplasty: Outcomes associated with intravenous tranexamic acid use in an academic medical center. SAGE open Med [Internet]. 2016;4:2050312116637024. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=4790417&tool=pmcentrez&rendertype=abstract
- Mak JCS, Fransen M, Jennings M, March L, Mittal R, Harris IA. Evidence-based review for patients undergoing elective hip and knee replacement. ANZ J Surg. 2014;84(1–2):17–24.
- Banerjee S, Issa K, Pivec R, McElroy MJ, Khanuja HS, Harwin SF, et al. Intraoperative pharmacotherapeutic blood management strategies in total knee arthroplasty. J Knee Surg [Internet]. 2013 Dec;26(6):379–85. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23955184
- Memtsoudis SG, Bs MH, Russell LA, Parvizi J, Cats-baril WL, Stundner O. Consensus Statement from the Consensus Conference on Bilateral Total Knee Arthroplasty Group. 2013;2649–57.
- Saucedo J, Marecek GS, Lee J, Huminiak L, Stulberg SD, Puri L. How accurately are we coding readmission diagnoses after total joint arthroplasty? J Arthroplasty [Internet]. Elsevier Inc.; 2013;28(7):1076–9. Available from: http://dx.doi.org/10.1016/j.arth.2013.05.006
- March GM, Elfatori S, Beaulé PE. Clinical experience with tranexamic acid during primary total hip arthroplasty. Hip Int [Internet]. 2013;23(1):72–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23397201
- Sukeik M, Alshryda S, Haddad FS, Mason JM. Systematic review and meta-analysis of the use of tranexamic acid in total hip replacement. J Bone Jt Surg Br [Internet]. 2011;93(1):39–46. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21196541
- Phan DL. Can tranexamic acid change preoperative anemia management during total joint arthroplasty? World J Orthop [Internet]. 2015;6(7):521. Available from: http://www.wjgnet.com/2218-5836/full/v6/i7/521.htm
- Clarke AM, Dorman T, Bell MJ. Blood loss and transfusion requirements in total joint arthroplasty. Ann R Coll Surg Engl [Internet]. 1992 Sep;74(5):360–3. Available from: http://www.ncbi.nlm.nih.gov/pubmed/1416710
- Machin JT, Batta V, Soler JA, Sivagaganam K, Kalairajah Y. Comparison of intra-operative regimes of tranexamic acid administration in primary total hip replacement. Acta Orthop Belg. 2014;80(2):228–33.
- Trice ME, Walker RH, D’Lima DD, Morris BA, Colwell CW. Blood loss and transfusion rate in noncemented and cemented/hybrid total hip arthroplasty. Is there a difference? A comparison of 25 matched pairs. Orthopedics [Internet]. 1999 Jan;22(1 Suppl):s141-4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9927115
- Rajesparan K, Biant LC, Ahmad M, Field RE. The effect of an intravenous bolus of tranexamic acid on blood loss in total hip replacement. J Bone Joint Surg Br. 2009;91(6):776–83.
- Xie J, Ma J, Yue C, Kang P, Pei F. Combined use of intravenous and topical tranexamic acid following cementless total hip arthroplasty: a randomised clinical trial. Hip Int [Internet]. 2016 Feb 8;26(1):36–42. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26391263
- Sano M, Hakusui H, Kojima C, Akimoto T. Absorption and Excretion of Tranexamic Acid following Intravenous, Intramuscular and Oral Administrations in Healthy Volunteers. Rinsho yakuri/Japanese J Clin Pharmacol Ther [Internet]. 1976;7(4):375–82. Available from: http://joi.jlc.jst.go.jp/JST.Journalarchive/jscpt1970/7.375?from=CrossRef
- Benoni G, Carlsson A, Petersson C, Fredin H. Does tranexamic acid reduce blood loss in knee arthroplasty? Am J Knee Surg [Internet]. 1995;8(3):88–92. Available from: http://www.ncbi.nlm.nih.gov/pubmed/7552611
- Husted H, Blønd L, Sonne-Holm S, Holm G, Jacobsen TW, Gebuhr P. Tranexamic acid reduces blood loss and blood transfusions in primary total hip arthroplasty: a prospective randomized double-blind study in 40 patients. Acta Orthop Scand [Internet]. 2003 Dec;74(6):665–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14763696
- Yamasaki S, Masuhara K, Fuji T. Postoperative Blood Loss in Cementless Total Hip Arthroplasty. J Bone Joint Surg Am. 2005;87–A(4):766–70.
- Ho KM, Ismail H. Use of intravenous tranexamic acid to reduce allogeneic blood transfusion in total hip and knee arthroplasty: a meta-analysis. Anaesth Intensive Care [Internet]. 2003 Oct;31(5):529–37. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14601276
- Lindoff C, Rybo G, Astedt B. Treatment with tranexamic acid during pregnancy, and the risk of thrombo-embolic complications. Thromb Haemost [Internet]. 1993 Aug 2;70(2):238–40. Available from: http://www.ncbi.nlm.nih.gov/pubmed/8236125
- Gandhi R, Evans HMK, Mahomed SR, Mahomed NN. Tranexamic acid and the reduction of blood loss in total knee and hip arthroplasty: a meta-analysis. BMC Res Notes. 2013;6:184.
- Gillette BP, DeSimone LJ, Trousdale RT, Pagnano MW, Sierra RJ. Low risk of thromboembolic complications with tranexamic acid after primary total hip and knee arthroplasty. Clin Orthop Relat Res [Internet]. 2013;471(1):150–4. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3528901&tool=pmcentrez&rendertype=abstract
- Kim TK, Chang CB, Koh IJ. Practical issues for the use of tranexamic acid in total knee arthroplasty: A systematic review. Knee Surgery, Sport Traumatol Arthrosc. 2014;22(8):1849–58.
- Lin ZX, Woolf SK. Safety, Efficacy, and Cost-effectiveness of Tranexamic Acid in Orthopedic Surgery. 2016;39(2):119–30.
- Bell D, Marasco S, Almeida A, Rowland M. Tranexamic Acid in cardiac surgery and postoperative seizures: a case report series. Heart Surg Forum [Internet]. 2010 Aug;13(4):E257-9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20719731
- Murkin JM, Falter F, Granton J, Young B, Burt C, Chu M. High-dose tranexamic acid is associated with nonischemic clinical seizures in cardiac surgical patients. Anesth Analg. 2010;110(2):350–3.
- Kratzer S, Irl H, Mattusch C, Bürge M, Kurz J, Kochs E, et al. Tranexamic Acid Impairs ?-Aminobutyric Acid Receptor Type A-mediated Synaptic Transmission in the Murine Amygdala: A Potential Mechanism for Drug-induced Seizures? Anesthesiology [Internet]. 2014;120(3):639–49. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24335749
- Cordero-Ampuero J, De Dios M. What are the risk factors for infection in hemiarthroplasties and total hip arthroplasties? Clin Orthop Relat Res. 2010;468(12):3268–77.
- Saleh K, Olson M, Resig S, Bershadsky B, Kuskowski M, Gioe T, et al. Predictors of wound infection in hip and knee joint replacement: results from a 20 year surveillance program. J Orthop Res [Internet]. 2002;20(3):506–15. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12038624%5Cnhttp://onlinelibrary.wiley.com/doi/10.1016/S0736-0266(01)00153-X/abstract